用于治疗线粒体疾病或病症和异质性的方法和组合物
阅读说明:本技术 用于治疗线粒体疾病或病症和异质性的方法和组合物 (Methods and compositions for treating mitochondrial diseases or disorders and heterogeneity ) 是由 五条理志 上大介 前田秀树 于 2019-08-13 设计创作,主要内容包括:本发明提供了用于产生线粒体替换的细胞(MirC)的方法和组合物和使用这些组合物治疗患有年龄相关疾病或综合征、线粒体疾病或病症或者另外需要线粒体替换的对象的治疗方法。还提供了产生具有线粒体疾病或病症的受体细胞的方法和组合物,以及产生或提高诱导多潜能干细胞(iPSC)的产量的方法和组合物。另外,还包括提高线粒体转移的方法和组合物。(The present invention provides methods and compositions for producing mitochondrial-replaced cells (MirC) and therapeutic methods for using these compositions to treat subjects having age-related diseases or syndromes, mitochondrial diseases or disorders, or otherwise in need of mitochondrial replacement. Also provided are methods and compositions for producing recipient cells having a mitochondrial disease or disorder, and methods and compositions for producing or increasing the yield of induced pluripotent stem cells (ipscs). Additionally, methods and compositions for improving mitochondrial transport are included.)
本发明申请主张2018年8月14日提交的美国临时专利申请No.62/718,891、2018年9月14日提交的美国临时专利申请No.62/731,731和2019年3月13日提交的美国临时专利申请No.62/817,987的权益,以上专利申请以其全部内容作为参考并入本文。
序列表
本发明申请包含以ASCII格式电子提交并且以其全部内容作为参考并入本文的序列表。2019年8月13日创建的所述ASCII拷贝的名称为14595-001-228_SL.txt并且大小为12,905字节。
1.技术领域
本发明提供了具有减少的线粒体DNA和/或线粒体DNA替换的细胞的组合物、用于产生它们的方法和用于治疗与遗传性或年龄相关的线粒体功能障碍有关的多种疾病的方法。
2.背景技术
线粒体在细胞内稳态中起到重要且关键的作用,并且参与广泛的疾病过程。它们参与胞内信号转导、细胞凋亡并执行多项生物化学工作,如丙酮酸盐氧化、三羧酸循环和氨基酸、脂肪酸、核苷酸和类固醇代谢。一项关键工作是它们在细胞能量代谢中的作用。这包括通过电子迁移链和氧化-磷酸化系统的β-脂肪酸氧化和ATP产生。线粒体呼吸链由嵌入内膜中的5个多亚基蛋白质复合物组成,其包括:复合物I(NADH-泛醌氧化还原酶)、复合物II(琥珀酸盐-泛醌氧化还原酶)、复合物III(泛醇-亚铁细胞色素c氧化还原酶)、复合物IV(细胞色素c氧化还原酶)和复合物V(FIFO ATP酶)。
哺乳动物线粒体基因组是含有37个基因的小、圆形双链分子,其包括13个蛋白-编码基因、22个转运RNA(tRNA)基因和2个核糖体RNA(rRNA)基因。其中,线粒体DNA翻译需要24个(22个tRNA和2个rRNA),并且13个编码呼吸链复合物的亚基。另外,核DNA(nDNA)编码线粒体中的约900个基因产物中的大部分。
线粒体疾病或病症是以功能障碍的线粒体为特征的临床异质性病症组。疾病发病可以发生在任何年龄并且可以显示出广泛的临床症状。线粒体疾病或病症可以涉及任何器官或组织,其特征性地涉及多个系统,通常影响高度依赖于需氧代谢的器官并且通常以高发病率和死亡率残酷地发展。线粒体疾病或病症是最常见的遗传性代谢病症组,并且是遗传性神经障碍的最常见形式。
线粒体疾病或病症可以由编码结构性线粒体蛋白或参与线粒体功能的蛋白的核DNA(nDNA)和/或线粒体DNA(mtDNA)中的基因突变引起。尽管一些线粒体病症仅影响单一器官(例如,Leber遗传性视神经病变[LHON]中影响眼睛),但是多种病症涉及多个器官系统并且以明显的神经学和肌病特征存在。尽管更频繁地涉及具有高能量需求的组织,如脑、肌肉和眼睛,但是患者的表型可以极为不同并且是非均质的。这种差异部分是由于几种因素,如异质性(单细胞和组织中突变DNA的百分比)的双重遗传控制(nDNA和mtDNA)水平、组织能量需求、母体遗传和有丝分裂分离。
患有线粒体疾病或病症的多位患者具有突变和野生型mtDNA的混合(被称为异质性);突变和野生型mtDNA的比例是决定细胞是否表达生物化学缺陷的关键因素。大部分致病性mtDNA突变是异质性的,在各个细胞内部具有突变和野生型mtDNA的混合。高异质性水平表示具有高水平的突变mtDNA和低水平的野生型mtDNA的细胞,而低异质性水平表示具有低水平的突变mtDNA和高水平的野生型mtDNA的细胞。来自患有线粒体疾病或病症的患者的单细胞中的研究已显示突变和野生型mtDNA的水平对于决定细胞表型是非常重要的。例如,如果它们含有高水平的突变mtDNA和低水平的野生型mtDNA(即高异质性水平),则细胞成为呼吸缺陷的。发生这种缺陷的阈值取决于准确的突变和细胞类型。通常,需要高突变mtDNA百分比水平(>50%)来产生细胞缺陷,但是如果以极高水平存在(通常mt tRNA突变),则一些mtDNA突变仅产生缺陷,而其它情况(如单一、大规模mtDNA缺失)当存在~60%的缺失的mtDNA时产生缺陷。例如,在具有m.8993T>G致病性变体的个体中,在患有Leigh综合征的那些人中观察到了比患有神经原性无力伴共济失调和视网膜色素变性(NARP)的那些中更高的突变mtDNA的百分比水平。另外,MELAS和MERRF中的临床表型与异质性相关(参见,例如,Chinnery,P.F.等人,Brain 120(Pt 10),1713-1721(1997))。
下一代测序技术的发展已显示出引起线粒体疾病或病症的多种突变。另外,对其它生物,如秀丽隐杆线虫(C.elegans)的研究已显示一些蛋白参与了异质性。例如,最近使用秀丽隐杆线虫(C.elegans)的研究表明在原始mtDNA的扰动后,线粒体未折叠蛋白反应(UPRmt)起作用以维持异质性并使突变mtDNA扩散(参见,例如,Lin,Y.F.等人,Nature 533,416-419,doi:10.1038/nature17989(2016))。然而,与哺乳动物细胞中的异质性维持和扩散有关的机制仍是未知的。
患有线粒体疾病或病症的患者的控制和治疗仍是困难的。对于绝大多数患者,病况残酷地发展,从而导致了很高的发病率,并且在受影响最严重的那些中,导致了死亡。除去内源mtDNA的典型方法包括用低浓度溴化乙锭(EtBr,已知的致癌剂和致畸剂)长期处理细胞,从而限制了其用于治疗目的的应用。除不期望的副作用的可能之外,EtBr规程可以花费数月,这进一步限制了其临床使用。此外,线粒体转移规程通常包括在外源线粒体转移前对内源mtDNA的完全消除,称为rho(ρ)0细胞。mtDNA的这种完全消除严重阻碍了细胞摄取外源线粒体的能力。
已尝试了其它线粒体转移规程来添加线粒体而不消除内源mtDNA,但是已发现这种方法对细胞无效或有害。例如,已报道使用简单的共培育的线粒体转移是无效的并且在不同细胞类型中也不是同样有效的。其它转移技术已包括使用创伤性仪器的注入,这对受体细胞有害,或者使用其它创伤性仪器,如纳米刀片,但是均不如共培育有效(Caicedo等人,Stem Cells International,(2017),2017卷,论文ID 7610414,第23页)。
因此,当前的线粒体转移方法不仅对于临床背景不实用,而且它们也是无效率的,对受体细胞有害的和/或时间密集的。因此,对于开发可以任选地在患有或怀疑患有线粒体疾病或病症以及与受损或功能障碍的线粒体有关的疾病或病症的对象的治疗中使用的用于线粒体转移的改善方法以及用于研究线粒体疾病或病症的改善模型的需要仍明显未满足。
3.
发明内容
在一个方面,本文提供了产生线粒体替换的细胞的方法,其包括:(a)将受体细胞与减少内源mtDNA拷贝数的试剂接触;(b)将所述受体细胞与所述试剂培育足够的一段时间以部分减少所述受体细胞中的内源mtDNA拷贝数;和(c)将(1)其中内源mtDNA已部分减少的来自步骤(b)的受体细胞和(2)来自健康供体的外源线粒体共培育足够的一段时间以将外源线粒体无创转移至所述受体细胞,借此产生线粒体替换的细胞。
在另一个方面,本文提供了治疗需要线粒体替换的对象的方法,其包括(a)离体或体外产生线粒体替换的细胞,其包括以下步骤:(i)将受体细胞与减少mtDNA拷贝数的试剂接触;(ii)将所述受体细胞与所述试剂培育足够的一段时间以部分减少所述受体细胞中的mtDNA拷贝数;和(iii)将(1)其中内源mtDNA已部分减少的来自步骤(ii)的受体细胞和(2)来自健康供体的外源线粒体共培育足够的一段时间以将外源线粒体无创转移至所述受体细胞,借此产生线粒体替换的细胞;和(b)将治疗有效量的来自步骤(a)的线粒体替换的受体细胞施用于需要线粒体替换的对象。
在另一个方面,本文提供了治疗患有或怀疑患有年龄相关疾病的对象的方法,所述方法包括:(a)离体或体外产生线粒体替换的细胞,其包括以下步骤:(i)将受体细胞与减少mtDNA拷贝数的试剂接触;(ii)将所述受体细胞与所述试剂培育足够的一段时间以部分减少所述受体细胞中的mtDNA拷贝数;和(iii)将(1)其中内源mtDNA已部分减少的来自步骤(ii)的受体细胞和(2)来自健康供体的外源线粒体共培育足够的一段时间以将外源线粒体无创转移至所述受体细胞,借此产生线粒体替换的细胞;和(b)将治疗有效量的来自步骤(a)的线粒体替换的受体细胞施用于患有或怀疑患有年龄相关疾病的对象。
在另一个方面,本文提供了治疗患有或怀疑患有线粒体疾病或病症的对象的方法,所述方法包括:(a)离体或体外产生线粒体替换的受体细胞,其包括以下步骤:(i)将受体细胞与减少mtDNA拷贝数的试剂接触;(ii)将所述受体细胞与所述试剂培育足够的一段时间以部分减少所述受体细胞中的mtDNA拷贝数;和(iii)将(1)其中内源mtDNA已部分减少的来自步骤(ii)的受体细胞和(2)来自健康供体的外源线粒体共培育足够的一段时间以将外源线粒体无创转移至所述受体细胞,借此产生线粒体替换的细胞;和(b)将治疗有效量的来自步骤(a)的线粒体替换的受体细胞施用于患有或怀疑患有线粒体疾病或病症的对象。
在本文所提供的方法的一些实施方式中,所述外源线粒体是功能性线粒体。在某些实施方式中,所述外源线粒体包含野生型mtDNA。在具体的实施方式中,所述外源线粒体是分离的线粒体。在其它实施方式中,所述分离的线粒体是完整线粒体。在一些实施方式中,所述外源线粒体是同种异体的。
本文还提供了产生线粒体替换的细胞的方法,其包括:(a)将受体细胞与减少内源mtDNA拷贝数的试剂接触;(b)将所述受体细胞与所述试剂培育足够的一段时间以部分减少所述受体细胞中的内源mtDNA拷贝数;和(c)将(1)其中内源mtDNA已部分减少的来自步骤(b)的受体细胞和(2)来自健康供体的外源mtDNA共培育足够的一段时间以将外源mtDNA无创转移至所述受体细胞,借此产生线粒体替换的细胞。
本发明公开还提供了治疗需要线粒体替换的对象的方法,其包括:(a)离体或体外产生线粒体替换的细胞,其包括以下步骤:(i)将受体细胞与减少mtDNA拷贝数的试剂接触(ii)将所述受体细胞与所述试剂培育足够的一段时间以部分减少所述受体细胞中的mtDNA拷贝数;和(iii)将(1)其中内源mtDNA已部分减少的来自步骤(ii)的受体细胞和(2)来自健康供体的外源mtDNA共培育足够的一段时间以将外源mtDNA无创转移至所述受体细胞,借此产生线粒体替换的细胞;和(b)将治疗有效量的来自步骤(a)的线粒体替换的受体细胞施用于需要线粒体替换的对象。
在另一个方面,本文提供了治疗患有或怀疑患有年龄相关疾病的对象的方法,所述方法包括:(a)离体或体外产生线粒体替换的细胞,其包括以下步骤:(i)将受体细胞与减少mtDNA拷贝数的试剂接触;(ii)将所述受体细胞与所述试剂培育足够的一段时间以部分减少所述受体细胞中的mtDNA拷贝数;和(iii)将(1)其中内源mtDNA已部分减少的来自步骤(ii)的受体细胞和(2)来自健康供体的外源mtDNA共培育足够的一段时间以将外源mtDNA无创转移至所述受体细胞,借此产生线粒体替换的细胞;和(b)将治疗有效量的来自步骤(a)的线粒体替换的受体细胞施用于患有或怀疑患有年龄相关疾病的对象。
在另一个方面,本文提供了治疗患有或怀疑患有线粒体疾病或病症的对象的方法,所述方法包括:(a)离体或体外产生线粒体替换的受体细胞,其包括以下步骤:(i)将受体细胞与减少mtDNA拷贝数的试剂接触;(ii)将所述受体细胞与所述试剂培育足够的一段时间以部分减少所述受体细胞中的mtDNA拷贝数;和(iii)将(1)其中内源mtDNA已部分减少的来自步骤(ii)的受体细胞和(2)来自健康供体的外源mtDNA共培育足够的一段时间以将外源mtDNA无创转移至所述受体细胞,借此产生线粒体替换的细胞;和(b)将治疗有效量的来自步骤(a)的线粒体替换的受体细胞施用于患有或怀疑患有线粒体疾病或病症的对象。
在本文所提供的方法的某些实施方式中,减少内源mtDNA拷贝数的试剂选自编码包含线粒体-靶向序列(MTS)和核酸内切酶的融合蛋白的多核苷酸、编码核酸内切酶的多核苷酸和小分子。在一些实施方式中,所述小分子是核苷反转录酶抑制剂(NRTI)。在其它实施方式中,所述多核苷酸由信使核糖核酸(mRNA)或者脱氧核糖核酸(DNA)组成。在其它实施方式中,所述受体细胞短暂表达所述融合蛋白。在其它实施方式中,所述核酸内切酶选自XbaI、EcoRI、BamHI、HindIII、PstI、Cas9、锌指核酸酶(ZFN)和转录激活子样效应因子核酸酶(TALEN)。在一些实施方式中,MTS靶向线粒体基质蛋白。在具体的实施方式中,所述线粒体基质蛋白选自细胞色素c氧化酶亚基IV、细胞色素c氧化酶亚基VIII和细胞色素c氧化酶亚基X。
在本文所提供的方法的一些实施方式中,减少内源mtDNA拷贝数的试剂将内源mtDNA拷贝数减少了约5%至约99%。在某些实施方式中,减少内源mtDNA拷贝数的试剂将内源mtDNA拷贝数减少了约30%至约70%。在其它实施方式中,减少内源mtDNA拷贝数的试剂将内源mtDNA拷贝数减少了约50%至约95%。在其它实施方式中,减少内源mtDNA拷贝数的试剂将内源mtDNA拷贝数减少了约60%至约90%。在一些实施方式中,减少内源mtDNA拷贝数的试剂减少了线粒体物质。
本文还提供了产生线粒体替换的细胞的方法,其包括:(a)将受体细胞与降低线粒体功能的试剂接触;(b)将所述受体细胞与所述试剂培育足够的一段时间以部分降低所述受体细胞中的内源线粒体功能;和(c)将(1)其中内源线粒体功能已部分降低的来自步骤(b)的受体细胞和(2)来自健康供体的外源线粒体共培育足够的一段时间以将外源线粒体无创转移至所述受体细胞,借此产生线粒体替换的细胞。
本发明公开还提供了产生线粒体替换的细胞的方法,其包括:(a)将受体细胞与降低线粒体功能的试剂接触;(b)将所述受体细胞与所述试剂培育足够的一段时间以部分降低所述受体细胞中的内源线粒体功能;和(c)将(1)其中内源线粒体功能已部分降低的来自步骤(b)的受体细胞和(2)来自健康供体的外源mtDNA共培育足够的一段时间以将外源mtDNA无创转移至所述受体细胞,借此产生线粒体替换的细胞。
在本文所提供的方法的一些实施方式中,降低线粒体功能的试剂短暂降低内源线粒体功能。在其它实施方式中,降低线粒体功能的试剂永久降低内源线粒体功能。
在本文所提供的方法的某些实施方式中,需要线粒体替换的对象具有功能障碍的线粒体;选自年龄相关疾病、线粒体疾病或病症、神经退行性疾病、视网膜疾病、糖尿病、听觉障碍、遗传疾病的疾病;或其组合。在一些实施方式中,所述神经退行性疾病选自肌萎缩性侧索硬化(ALS)、亨廷顿病、阿尔茨海默氏病、帕金森氏病、弗里德棘希氏共济失调、腓骨肌萎缩症和脑白质病变。在具体的实施方式中,所述视网膜疾病选自年龄相关性黄斑变性、黄斑水肿和青光眼。
在本文所提供的方法的一些实施方式中,所述年龄相关疾病选自自体免疫疾病、代谢疾病、遗传疾病、癌症、神经退行性疾病和免疫衰老。在本文所提供的方法的某些实施方式中,所述代谢疾病是糖尿病。在其它实施方式中,所述神经退行性疾病是阿尔茨海默氏病或帕金森氏病。在其它实施方式中,所述遗传疾病选自早年衰老综合症、沃纳综合征和亨廷顿病。
在本文所提供的方法的某些实施方式中,所述线粒体疾病或病症是由线粒体DNA异常、核DNA异常或两者造成的。在具体的实施方式中,由线粒体DNA异常所引起的线粒体疾病或病症选自慢性进行性眼外肌麻痹(CPEO)、皮尔逊综合症、科恩-塞亚综合征(Kearns-Sayre Syndrome)(KSS)、糖尿病伴耳聋(DAD)、线粒体糖尿病、Leber遗传性视神经病变(LHON)、LHON-加(LHON-plus)、神经病、共济失调和视网膜色素变性综合征(NARP)、母系遗传的Leigh综合征(MILS)、线粒体脑肌病、乳酸性酸中毒和中风样发作(MELAS)、肌阵挛性癫痫伴碎红纤维病(MERRF)、家族性双侧纹状体坏死/纹状体黑质变性(FBSN)、Luft病、氨基糖苷引起的耳聋(AID)和线粒体DNA综合征的多种缺失。在其它
具体实施方式
中,所述由核DNA异常所引起的线粒体疾病或病症选自线粒体DNA缺失综合征-4A、线粒体隐性共济失调综合征(MIRAS)、线粒体神经胃肠道脑肌病(MNGIE)、线粒体DNA缺失综合征(MTDPS)、DNA聚合酶γ(POLG)-相关病症、感觉性共济失调性神经病伴构音障碍及眼肌麻痹(SANDO)、伴脑干与脊髓受累以及乳酸升高的脑白质病(LBSL)、辅酶Q10缺乏症、Leigh综合征、线粒体复合物异常、延胡索酸酶缺乏症、α-酮戊二醛脱氢酶复合物(KGDHC)缺乏症、琥珀酰辅酶A连接酶缺乏症、丙酮酸脱氢酶复合物缺乏症(PDHC)、丙酮酸羧化酶缺乏症(PCD)、肉毒碱棕榈酰转移酶I(CPT I)缺乏症、肉毒碱棕榈酰转移酶II(CPT II)缺乏症、肉碱-酰基-肉碱(CACT)缺乏症、常染色体显性-/常染色体隐性-进行性眼外肌麻痹(ad-/ar-PEO)、婴儿型脊髓小脑萎缩(IOSCA)、线粒体肌病(MM)、脊髓性肌萎缩(SMA)、生长停滞、氨基酸尿、胆汁郁积、铁过载、早期死亡(GRACILE)和2A型Charcot-Marei-Tooth病(CMT2A)。
在本文所提供的方法的一些实施方式中,内源mtDNA编码功能障碍的线粒体。在具体的实施方式中,内源mtDNA包含突变mtDNA。在其它实施方式中,受体细胞中的内源mtDNA包含野生型mtDNA。在其它实施方式中,内源mtDNA包含与线粒体疾病或病症有关的mtDNA。在一些实施方式中,内源mtDNA是异质的。在具体的实施方式中,受体细胞具有功能障碍的内源线粒体。
在本文所提供的方法的某些实施方式中,相对于与减少内源mtDNA拷贝数的试剂接触前的受体细胞的总mtDNA拷贝数,线粒体替换的细胞具有不大于约1.1倍,约1.2倍,约1.3倍,约1.4倍,约1.5倍或以上的总mtDNA拷贝数。
在一些实施方式中,所述受体细胞是动物细胞或植物细胞。在某些实施方式中,所述动物细胞是哺乳动物细胞。在具体的实施方式中,所述受体细胞是体细胞。在其它实施方式中,所述受体细胞是骨髓细胞。在一些实施方式中,所述骨髓细胞是造血干细胞(HSC)或者间质干细胞(MSC)。在其它实施方式中,所述受体细胞是癌细胞。在其它实施方式中,所述受体细胞是原代细胞。在其它实施方式中,所述受体细胞是免疫细胞。在具体的实施方式中,所述免疫细胞选自T细胞、吞噬细胞、小胶质细胞和巨噬细胞。在其它实施方式中,所述T细胞是CD4+T细胞。在其它实施方式中,所述T细胞是CD8+T细胞。在某些实施方式中,所述T细胞是嵌合抗原受体(CAR)T细胞。
在本文所提供的方法的另一个实施方式中,所述外源线粒体和/或外源mtDNA是稳定的。在一些实施方式中,所述外源mtDNA改变了受体细胞中的异质性。
在本文所提供的方法的一些方面,所述方法还包括递送小分子、肽或蛋白。
本发明公开还提供了本文所提供的方法,其还包括在将所述受体细胞与外源线粒体和/或外源mtDNA共培育之前,将所述受体细胞与第二活性剂接触。在某些实施方式中,所述第二活性剂选自大分子、小分子或细胞疗法,并且所述第二活性剂任选地选自雷帕霉素、NR(烟酰胺核糖)、苯扎贝特、艾地苯醌、重酒石酸巯基乙胺(RP103)、艾拉米肽(elamipretide)(MTP131)、奥玛韦隆(omaveloxolone)(RTA408)、KH176、凡替醌酮(Vatiquinone)(Epi743)、硫辛酸、A0001(α-生育醌)、线粒体CoQ10(MitoQ)、SkQ1(Visomitin)、白藜芦醇、姜黄素、生酮治疗、缺氧和内吞激活剂。在一些实施方式中,所述内吞激活剂是细胞代谢的调节剂。在具体的实施方式中,细胞代谢的调节剂包括营养饥饿、化学抑制剂或小分子。在其它实施方式中,所述化学抑制剂或所述小分子是mTOR抑制剂。在其它实施方式中,所述mTOR抑制剂包括雷帕霉素或其衍生物。
本发明公开还提供了组合物,其包含通过以下方法获得的一种或多种线粒体替换的细胞:(a)将受体细胞与减少内源mtDNA拷贝数的试剂接触;(b)将所述受体细胞与所述试剂培育足够的一段时间以部分减少所述受体细胞中的内源mtDNA拷贝数;和(c)将(1)其中所述内源mtDNA已部分减少的来自步骤(b)的受体细胞和(2)来自健康供体的外源线粒体共培育足够的一段时间以将外源线粒体无创转移至所述受体细胞,借此产生线粒体替换的细胞,其中所述线粒体替换的细胞包含大于5%的外源mtDNA。
本发明公开还提供了通过以下方法获得的一种或多种线粒体替换的细胞的组合物:(a)将受体细胞与减少内源mtDNA拷贝数的试剂接触;(b)将所述受体细胞与所述试剂培育足够的一段时间以部分减少所述受体细胞中的内源mtDNA拷贝数;和(c)将(1)其中内源mtDNA已部分减少的来自步骤(b)的受体细胞和(2)来自健康供体的外源mtDNA共培育足够的一段时间以将外源mtDNA无创转移至所述受体细胞,借此产生线粒体替换的细胞,其中所述线粒体替换的细胞包含大于5%的外源mtDNA。在本文提供的组合物的一些实施方式中,相对于与减少内源mtDNA拷贝数的试剂接触前的受体细胞的总mtDNA拷贝数,所述一种或多种线粒体替换的细胞包含不大于约1.1倍,约1.2倍,约1.3倍,约1.4倍,约1.5倍或以上的总mtDNA拷贝数。
在另一个方面,本文提供了用于在产生一种或多种线粒体替换的细胞的方法中使用的组合物,其包含减少内源mtDNA拷贝数的试剂和第二活性剂。在一些实施方式中,所述组合物还包含一种或多种受体细胞或它们的组合。在某些实施方式中,所述组合物还包含外源mtDNA、外源mtDNA和/或外源线粒体。
在本文提供的组合物的某些实施方式中,减少内源mtDNA拷贝数的试剂是小分子或融合蛋白。在一些实施方式中,所述小分子是核苷反转录酶抑制剂(NRTI)。在其它实施方式中,所述融合蛋白包含切割mtDNA的核酸内切酶和线粒体靶向序列(MTS)。在一些实施方式中,所述核酸内切酶切割野生型mtDNA。在具体的实施方式中,所述核酸内切酶选自XbaI、EcoRI、BamHI、HindIII、PstI、Cas9、锌指核酸酶(ZFN)和转录激活子样效应因子核酸酶(TALEN)。在一些实施方式中,所述MTS靶向线粒体基质蛋白。在其它实施方式中,所述线粒体基质蛋白选自细胞色素c氧化酶亚基IV、细胞色素c氧化酶亚基VIII和细胞色素c氧化酶亚基X。在具体的实施方式中,短暂表达所述融合蛋白。
在本文提供的组合物的一些实施方式中,内源mtDNA拷贝数的减小是部分减小。在某些实施方式中,所述部分减小是约5%至约99%的内源mtDNA的减小。在具体的实施方式中,所述部分减小是约50%至约95%的内源mtDNA拷贝数的减小。在其它实施方式中,所述部分减小是约60%至约90%的内源mtDNA拷贝数的减小。
本发明公开还提供了组合物,其包含通过以下方法获得的一种或多种线粒体替换的细胞:(a)将受体细胞与降低线粒体功能的试剂接触;(b)将所述受体细胞与所述试剂培育足够的一段时间以部分降低所述受体细胞中的内源线粒体功能;和(c)将(1)其中内源线粒体功能已部分降低的来自步骤(b)的受体细胞和(2)来自健康供体的外源线粒体共培育足够的一段时间以将外源线粒体无创转移至所述受体细胞,借此产生线粒体替换的细胞,其中所述线粒体替换的细胞包含大于5%的外源mtDNA。
在另一个方面,本文提供了通过以下方法获得的一种或多种线粒体替换的细胞的组合物:(a)将受体细胞与降低线粒体功能的试剂接触;(b)将所述受体细胞与所述试剂培育足够的一段时间以部分降低所述受体细胞中的内源线粒体功能;和(c)将(1)其中内源线粒体功能已部分减少的来自步骤(b)的受体细胞和(2)来自健康供体的外源mtDNA共培育足够的一段时间以将外源mtDNA无创转移至所述受体细胞,借此产生线粒体替换的细胞,其中所述线粒体替换的细胞包含大于5%的外源mtDNA。在一些实施方式中,相对于与减少内源mtDNA拷贝数的试剂接触前的受体细胞的总mtDNA拷贝数,所述一种或多种线粒体替换的细胞包含不大于约1.1倍,约1.2倍,约1.3倍,约1.4倍,约1.5倍或以上的总mtDNA拷贝数。
本发明公开还提供了用于在产生一种或多种线粒体替换的细胞的方法中使用的组合物,所述组合物包含降低线粒体功能的试剂和第二活性剂。在一些实施方式中,所述组合物还包含外源线粒体、一种或多种受体细胞或它们的组合。在其它实施方式中,所述组合物还包含外源mtDNA。
在本文提供的组合物的一些实施方式中,所述一种或多种线粒体替换的细胞包含野生型外源mtDNA。
本文还提供了还包含第二活性剂的组合物。在一些实施方式中,所述第二活性剂选自大分子、小分子或细胞疗法,并且所述第二活性剂任选地选自雷帕霉素、NR(烟酰胺核糖)、苯扎贝特、艾地苯醌、重酒石酸巯基乙胺(RP103)、艾拉米肽(elamipretide)(MTP131)、奥玛韦隆(omaveloxolone)(RTA408)、KH176、凡替醌酮(Vatiquinone)(Epi743)、硫辛酸、A0001(α-生育醌)、线粒体CoQ10(MitoQ)、SkQ1(Visomitin)、白藜芦醇、姜黄素、生酮治疗、缺氧和内吞激活剂。在具体的实施方式中,所述内吞激活剂是内涵素-依赖性内吞途径的激活剂。在一些实施方式中,所述内吞激活剂是内涵素-依赖性内吞途径的激活剂。在其它实施方式中,所述内涵素-依赖性内吞途径选自CLIC/GEEC内吞途径、Arf6-依赖性内吞、脂阀结构蛋白-依赖性内吞、巨胞饮、环状膜皱褶(circular doral ruffles)、吞噬和反式-内吞。在其它实施方式中,所述内涵素-依赖性内吞途径是巨胞饮。在具体的实施方式中,所述内吞激活剂包含营养胁迫和/或mTOR抑制剂。在一些实施方式中,所述mTOR抑制剂包含雷帕霉素或其衍生物。
在某些实施方式中,本发明公开还提供了其中所述一种或多种线粒体替换的细胞的总mtDNA拷贝数包含大于5%的外源mtDNA的组合物。在一些实施方式中,所述一种或多种线粒体替换的细胞的总mtDNA拷贝数包含大于30%的外源mtDNA。在具体的实施方式中,所述一种或多种线粒体替换的细胞的总mtDNA拷贝数包含大于50%的外源mtDNA。在其它实施方式中,所述一种或多种线粒体替换的细胞的总mtDNA拷贝数包含大于75%的外源mtDNA。
在本文提供的组合物的一些实施方式中,所述外源线粒体是分离的线粒体。在具体的实施方式中,所述分离的线粒体是完整的。在一些实施方式中,所述外源线粒体和/或外源mtDNA是同种异体的。在具体的实施方式中,所述外源线粒体还包含外源mtDNA。
在本文提供的组合物的某些实施方式中,所述一种或多种细胞是动物细胞或植物细胞。在一些实施方式中,所述动物细胞是哺乳动物细胞。在具体的实施方式中,所述细胞是体细胞。在其它实施方式中,所述体细胞是上皮细胞。在其它实施方式,所述上皮细胞是胸腺上皮细胞(TECs)。在其它实施方式中,所述体细胞是免疫细胞。在某些实施方式中,所述免疫细胞是T细胞。在具体的实施方式中,所述T细胞是CD4+ T细胞。在其它实施方式中,所述T细胞是CD8+ T细胞。在一些实施方式中,所述T细胞是嵌合抗原受体(CAR)T细胞。在其它实施方式中,所述免疫细胞是吞噬细胞。在某些实施方式中,所述一种或多种线粒体替换的细胞是骨髓细胞。在具体的实施方式中,所述骨髓细胞是造血干细胞(HSC)或者间质干细胞(MSC)。
在本文提供的组合物的一些实施方式中,所述一种或多种线粒体替换的细胞比具有同质内源mtDNA的等基因细胞的存活性更强。在其它实施方式中,所述一种或多种线粒体替换的细胞在杀死癌细胞、治疗年龄相关疾病、治疗线粒体疾病或病症、治疗神经退行性疾病、治疗糖尿病或遗传疾病中是有效的。
在本文提供的组合物的某些实施方式中,所述组合物还包含小分子、肽或蛋白。
本文还提供了用于在细胞中延缓衰老和/或延长寿命的组合物,其包括:(a)具有内源线粒体的衰老或近衰老细胞;(b)来自未衰老的细胞的分离的外源线粒体;和(c)减少内源mtDNA拷贝数的试剂。在一些实施方式中,所述试剂是融合蛋白。在某些实施方式中,所述融合蛋白包含切割mtDNA的核酸内切酶和线粒体靶向序列(MTS)。在具体的实施方式中,所述核酸内切酶切割野生型mtDNA。在一些实施方式中,所述核酸内切酶选自XbaI、EcoRI、BamHI、HindIII、PstI、Cas9、锌指核酸酶(ZFN)和转录激活子样效应因子核酸酶(TALEN)。在其它实施方式中,所述MTS靶向线粒体基质蛋白。在其它实施方式中,所述线粒体基质蛋白选自细胞色素c氧化酶亚基IV、细胞色素c氧化酶亚基VIII和细胞色素c氧化酶亚基X。在某些实施方式中,在所述衰老或近衰老细胞中短暂表达所述融合蛋白。
本发明公开还提供了用于在细胞中延缓衰老和/或延长寿命的组合物,其包括:(a)具有内源线粒体的衰老或近衰老细胞;(b)来自未衰老的细胞的分离的外源线粒体;和(c)降低线粒体功能的试剂。在一些实施方式中,所述降低线粒体功能的试剂短暂降低内源线粒体功能。在其它实施方式中,降低线粒体功能的试剂永久降低内源线粒体功能。在一些实施方式中,来自未衰老的细胞的外源线粒体相对于内源线粒体具有提高的功能。
在一些实施方式中,用于在细胞中延缓衰老和/或延长寿命的组合物还包含第二活性剂。在具体的实施方式中,所述第二活性剂选自大分子、小分子或细胞疗法,并且所述第二活性剂任选地选自雷帕霉素、NR(烟酰胺核糖)、苯扎贝特、艾地苯醌、重酒石酸巯基乙胺(RP103)、艾拉米肽(elamipretide)(MTP131)、奥玛韦隆(omaveloxolone)(RTA408)、KH176、凡替醌酮(Vatiquinone)(Epi743)、硫辛酸、A0001(α-生育醌)、线粒体CoQ10(MitoQ)、SkQ1(Visomitin)、白藜芦醇、姜黄素、生酮治疗、缺氧和内吞激活剂。在一些实施方式中,所述内吞激活剂是内涵素-依赖性内吞途径的激活剂。在具体的实施方式中,所述内涵素-依赖性内吞途径选自CLIC/GEEC内吞途径、Arf6-依赖性内吞、脂阀结构蛋白-依赖性内吞、巨胞饮、环状膜皱褶(circular doral ruffles)、吞噬和反式-内吞。在其它实施方式中,所述内涵素-依赖性内吞途径是巨胞饮。在一些实施方式中,所述内吞激活剂包含营养胁迫和/或mTOR抑制剂。在某些实施方式中,所述mTOR抑制剂包含雷帕霉素或其衍生物。
在另一个方面,本发明公开还提供了包含具有来自健康供体的外源线粒体的线粒体替换的细胞的分离群体的药物组合物,其中通过本文所提供的用于获得线粒体替换的细胞的任何方法获得所述细胞。在另一个方面,本发明公开提供了包含具有来自健康供体的外源mtDNA的线粒体替换的细胞的分离群体的药物组合物,其中通过本文所提供的用于获得线粒体替换的细胞的任何方法获得所述细胞。在一些实施方式中,所述包含具有来自健康供体的外源mtDNA的线粒体替换的细胞的分离群体的药物组合物还包含外源线粒体。
例如,在一些实施方式中,通过产生线粒体替换的细胞的方法获得包含来自健康供体的外源线粒体的药物组合物,所述方法包括(a)将受体细胞与减少内源mtDNA拷贝数的试剂接触;(b)将所述受体细胞与所述试剂培育足够的一段时间以部分减少所述受体细胞中的内源mtDNA拷贝数;和(c)将(1)其中所述内源mtDNA已部分减少的来自步骤(b)的受体细胞和(2)来自健康供体的外源线粒体共培育足够的一段时间以将外源线粒体无创转移至所述受体细胞,借此产生线粒体替换的细胞。在某些实施方式中,通过以下方法获得所述细胞,所述方法包括:(a)将受体细胞与降低线粒体功能的试剂接触;(b)将所述受体细胞与所述试剂培育足够的一段时间以部分降低所述受体细胞中的内源线粒体功能;和(c)将(1)其中内源线粒体功能已部分降低的来自步骤(b)的受体细胞和(2)来自健康供体的外源线粒体共培育足够的一段时间以将外源线粒体无创转移至所述受体细胞,借此产生线粒体替换的细胞。
在其它实施方式中,通过以下方法获得所述细胞,所述方法包括:(a)将受体细胞与减少内源mtDNA拷贝数的试剂接触;(b)将所述受体细胞与所述试剂培育足够的一段时间以部分减少所述受体细胞中的内源mtDNA拷贝数;和(c)将(1)其中内源mtDNA已部分减少的来自步骤(b)的受体细胞和(2)来自健康供体的外源mtDNA共培育足够的一段时间以将外源mtDNA无创转移至所述受体细胞,借此产生线粒体替换的细胞。在其它实施方式中,通过以下方法获得所述细胞,所述方法包括:(a)将受体细胞与降低线粒体功能的试剂接触;(b)将所述受体细胞与所述试剂培育足够的一段时间以部分降低所述受体细胞中的内源线粒体功能;和(c)将(1)其中内源线粒体功能已部分降低的来自步骤(b)的受体细胞和(2)来自健康供体的外源mtDNA共培育足够的一段时间以将外源mtDNA无创转移至所述受体细胞,借此产生线粒体替换的细胞。
在本文所提供的药物组合物的某些实施方式中,通过以下方法获得所述细胞,所述方法还包括在将所述受体细胞与外源线粒体和/或外源mtDNA共培育之前,将所述受体细胞与第二活性剂接触。在一些实施方式中,所述第二活性剂选自大分子、小分子或细胞疗法,并且所述第二活性剂任选地选自雷帕霉素、NR(烟酰胺核糖)、苯扎贝特、艾地苯醌、重酒石酸巯基乙胺(RP103)、艾拉米肽(elamipretide)(MTP131)、奥玛韦隆(omaveloxolone)(RTA408)、KH176、凡替醌酮(Vatiquinone)(Epi743)、硫辛酸、A0001(α-生育醌)、线粒体CoQ10(MitoQ)、SkQ1(Visomitin)、白藜芦醇、姜黄素、生酮治疗、缺氧和内吞激活剂。在具体的实施方式中,所述内吞激活剂是细胞代谢的调节剂。在其它实施方式中,细胞代谢的调节剂包括营养饥饿、化学抑制剂或小分子。在其它实施方式中,所述化学抑制剂或所述小分子是mTOR抑制剂。在其它实施方式中,所述mTOR抑制剂包含雷帕霉素或其衍生物。
在本文所提供的药物组合物的某些实施方式中,所述药物组合物还包含药物可用的载体。
在本文所提供的药物组合物的一些实施方式中,所述细胞是T细胞。在其它实施方式中,所述细胞是造血干细胞。
4.附图说明
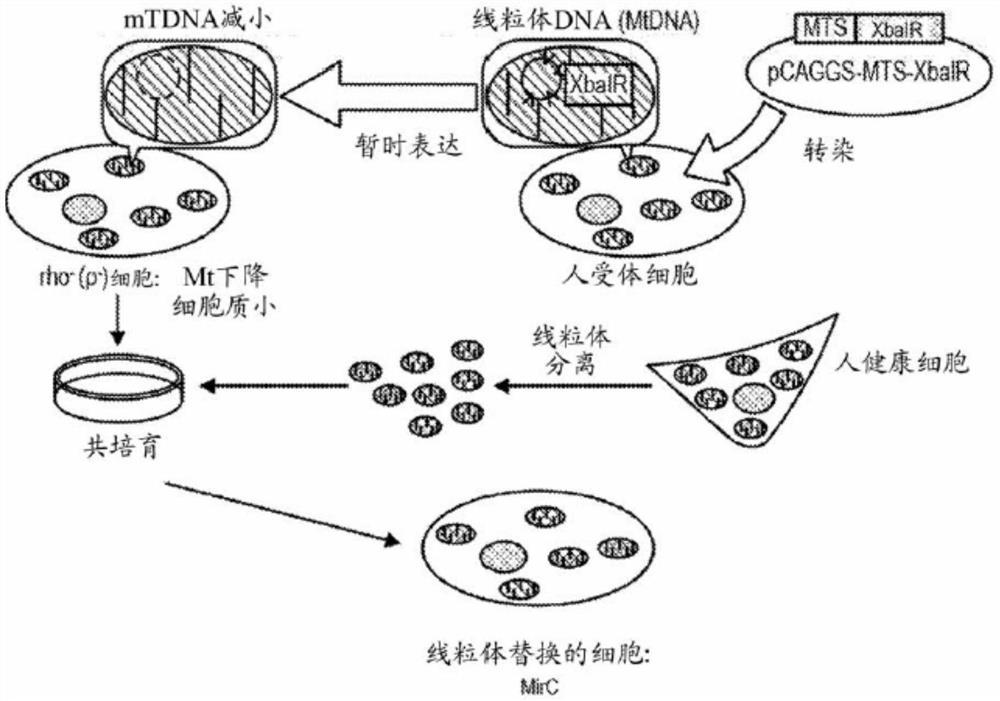
图1A显示了线粒体替换的细胞(MirC)的产生方案。
图1B显示了线粒体靶向序列(MTS)-XbaI限制性内切酶(XbaIR)质粒的质粒构建体。
图1C显示了通过XbaI限制性内切酶在多个位点消化分离的线粒体DNA,然而线粒体DNA的NotI消化导致产生了单一片段,如通过线粒体DNA的剑桥参考序列(CRS)所预测的。
图1D显示了人线粒体DNA上的5个XbaIR核酸内切酶位点(1193、2953、7440、8286、10256),如通过剑桥参考序列(CRS)所预测的。
图1E显示了在使用电转化仪(Nucleofector)的融合MTS-绿色荧光蛋白(GFP)质粒的吸收之后,人皮肤成纤维细胞在相差(左图)、绿色荧光蛋白的免疫荧光(中间)和合并视野(右图)下的显微镜学。顶部,低放大倍数。底部,高放大倍数。
图1F显示了pCAGGS-MTS-EGFP-PuroR和pCAGGS-MTS-XbaIR-PuroR质粒的构建体。
图1G显示了使用四甲基罗丹明,甲酯(TMRM)通过线粒体-特异性染色,外源转基因产物MTS-EGFP在线粒体中的定位。
图2A显示了相对于未接触的细胞,将MTS-XbaIR核酸内切酶方法(顶部)与使用溴化乙锭(EtBr)的传统方法(中间)相比较的时间表的方案。
图2B显示了相对于未接触的细胞,在与MTS-XbaIR核酸内切酶方法或者溴化乙锭处理接触后,人β-肌动蛋白(Actb),左列,和线粒体DNA(mtDNA),右列,的定量。与EtBr处理相比,XbaIR导致mtDNA更大的减小。Actb被用作管家基因。
图2C显示了基于线粒体中表达的DsRed荧光,相对于EtBr处理,在暴露于MTS-XbaIR的基因转移后,线粒体的更大的减小。
图2D显示了使用通过使用TMRM的FACS分析,在与MTS-XbaIR或EtBr的基因转移接触的细胞中,线粒体膜电位(线粒体含量的替代标志物)的半定量,并且显示MTS-XbaIR导致线粒体的更大的减小。
图2E显示了在基因转移系统中在14天内的转基因表达的时间过程定量。
图2F和图2G显示了在嘌罗霉素选择之前(“前”)和之后(“后”),在具有GFP的质粒的转移后的荧光图像(图2F),并且GFP/线粒体的比的定量(图2G)显示了在嘌罗霉素选择后GFP质粒的富集。
图3A显示了线粒体替换的时间表的方案。TF:XbaIR的基因转染或空转染;Puro:用于基因转移细胞富集的嘌罗霉素;U+:尿嘧啶核苷的添加以挽救缺少线粒体ATP生产的ρ(-)细胞;Mt Tx:线粒体转移;NHDF:正常人皮肤成纤维细胞;EPC100:胎盘静脉内皮-来源的细胞系。
图3B显示如通过TMRM染色所测量的,在第6天,线粒体在XbaIR的基因转移后减少(顶部),但是在阴性对照载体表达GFP转移后不减少(底部)。
图3C显示了在XbaIR或GFP转染的基因转染后,相对于NHDF细胞中的核β-肌动蛋白水平,通过人12S rRNA的qPCR估计的线粒体DNA拷贝数的定量。将线粒体转移到所指明的受体细胞中(“Mt Tx”)。XbaIR导致线粒体DNA显著降低,这在外源线粒体转移后可以挽救至与控制处理细胞相当的水平。N=3,*p<0.01。
图3D显示了来自时间间隔拍摄(time lapse movie)的照片:左上:ρ(-)细胞与分离且DsRed-标记的线粒体的共培养;右上:作为对照的ρ(-);左下:NHDF与线粒体的共培养;右下:NHDF的空转染子与线粒体的共培养;
图3E显示了垂直按时间顺序布置的来自图3D中所示的时间间隔拍摄的一系列10幅静止图像;
图3F显示了通过FACS分析的DsRed标记的线粒体的测量并且显示与先前所述方法相比,本发明(“DsRed-Mt EPC100”)导致外源线粒体吸收提高。
图3G和图3H显示了在使用或不使用抗霉素处理的ρ(0)细胞中的线粒体转移后,DsRed标记的线粒体(图3G)和相衬(图3H)显微镜图片,并且表明在线粒体完全破坏的细胞中没有发生外源线粒体的吞没。
图3I显示了垂直按时间顺序布置的来自图3G中所示的时间间隔拍摄的一系列5幅静止图像。
图3J显示了在ρ(-)细胞中或者在与Ds-红线粒体共培育的ρ(-)空转染细胞或未处理的细胞(附加的Mt)中,每24小时所测量的DsRed-标记的分离的外源线粒体的荧光强度的定量。
图4A显示了使用DsRed标记的线粒体作为供体并且使用EGFP标记的细胞作为受体,在通过受体细胞的吞没后,测量供体线粒体的命运的方案。
图4B显示了来自观察具有GFP标记的线粒体的受体细胞中吞没的外源线粒体(指示为红色)的拍摄的代表性图象。通过使用超精度显微镜记录拍摄,并且识别少数融合图象,并且大部分供体线粒体单独存在于预先存在的线粒体中。
图4C显示了所述融合的立体重构照片。
图4D显示了与线粒体转移信号融合的基因编码DsRed的NHDF转移的照片。
图4E显示了与TFAM融合的基因编码EGFP的EPC100转移的照片。
图4F显示了使用DsRed标记细胞作为受体并且使用TFAM靶向EGFP作为供体线粒体的线粒体转移的时间过程。
图4G显示在外源线粒体与受体细胞短暂接触后,外源TFAM稳定植入预先存在的线粒体中,表明类似于口对口摄入,通过短暂接触,将包括TFAM的线粒体拟核转移至预先存在的线粒体中。
图5A显示了具有指明高变(“HV”)区1/2和5个引物以识别NHDF和EPC100之间的差异的人线粒体DNA的剑桥参考序列(CRS)的完整环状线粒体DNA;
图5B显示了NHDF对照受体细胞(SEQ ID NO:1)、EPC100对照供体细胞(SEQ ID NO:2)、无线粒体替换的NHDF来源的ρ(-)细胞(SEQ ID NO:3)和具有线粒体替换的NHDF来源的ρ(-)细胞(SEQ ID NO:4)中围绕hmt16362的核苷酸的DNA测序数据,并且显示在hmt16362,具有线粒体替换的NHDF来源的ρ(-)细胞(SEQ ID NO:4)从原始受体细胞中的A改变为供体mtDNA中的G。
图5C显示了用于围绕hmt16362的人线粒体DNA D-环的HV1区(SEQ ID NO:8)扩增的hmt16318-F(SEQ ID NO:6)和hmt16414-R(SEQ ID NO:9)的引物组,以及设计用于TaqManSNP基因分型测定的NHDF特异性探针(SEQ ID NO:5)和EPC100特异性探针(SEQ ID NO:7)。
图5D显示了亲代NHDF和EPC100细胞系中,或者用XbaIR处理的,具有(XbaIR Mt+)或不具有来自EPC100细胞的线粒体(XbaIR Mt-)的NHDF细胞中的NHDF特异性hmtDNA(左图)和EPC100特异性hmtDNA(右图)的定量,并且显示EPC100线粒体成功转移到XbaIR Mt+细胞中,如通过使用单核苷酸多态性测定(SNP)所评价的。
图6A显示了来自使用Oroboros Oxygraph-2k所实施的线粒体功能测定的代表性氧气描记(oxygraphy),并且表明相对于对照NHDF细胞(顶部)和无线粒体替换的ρ(-)NHDF细胞(中间),具有线粒体替换的NHDF细胞(ρ(-)Mt)(底部)恢复了线粒体功能。机器以红线显示了呼吸流量(pmol/sec/1×106个细胞,右侧轴)并且以蓝线显示了氧浓度(μM,左侧轴)。
图6B显示每个阶段的呼吸流量(常规,电子传递体系(Electron TransferSystem,ETS),ROX)、游离常规活性(线粒体ATP产生)、质子泄露和耦合效率表明相对于NHDF对照细胞和无mtDNA替换的NHDF(ρ(-)),NHDF细胞(ρ(-)Mt)中的线粒体替换恢复了线粒体功能。
图6C显示了时间间隔显微照相,其使得能够估计基于细胞表面积的连续细胞数目,并且证明ρ(-)细胞在第3至12天之间处于静止状态,然而线粒体替换的细胞在第6天之后恢复了生长能力。
图6D显示了用于检验巨胞饮的分子机制的规程的方案,其包括用MTS-XbaIR-P2A-PuroR质粒转染NHDF细胞,用嘌罗霉素选择,然后将细胞血清饥饿60min或者用棕榈酸(PA)或雷帕霉素处理细胞24小时。
图6E-图6H显示了用于S6激酶磷酸化(图6E)和AMPK磷酸化(图6G)的WESTM分析,以及分别地相应WESTM印迹(图6F)和(图6H)的定量,其表明在ρ(-)细胞中AMPK被激活并且mTOR被完全抑制。Rapa:雷帕霉素,PA:棕榈酸,EAA-:必需氨基酸-缺乏。
图6I显示了用于检验MirC产生规程的背景中,mTOR介导的巨胞饮的效果的规程。
图6J-图6L显示了对照(顶部)、空转染细胞(中间)和使用或不使用雷帕霉素处理或者使用或不使用棕榈酸(PA)处理的ρ(-)细胞中的DsRed标记的线粒体吸收的定量(图6J和图6K)和FACS分析(图6L)。相对于空TF细胞对照,ρ(-)细胞显示出更大的线粒体吸收,并且在雷帕霉素处理之后,线粒体吸收显著提高,然而棕榈酸降低了ρ(-)细胞中的线粒体吸收。
图7A显示了显示线粒体DNA中的ND3基因的呼吸链复合物I(CI)亚基中的10158T>C的Leigh综合征相关突变的完整mtDNA序列。
图7B显示了EPC100细胞(顶部;SEQ ID NO:10)和Leigh综合征(7SP)成纤维细胞(底部;SEQ ID NO:11)中的ND3内围绕hmt10158的核苷酸的DNA测序数据,并且用主波中的C和次波中的T的马赛克显示了突变10158T>C,从而表明了异质性。
图7C显示了来自时间间隔拍摄的照片,其表明在具有和不具有外源线粒体的ρ(-)7SP成纤维细胞两者中情况类似,如NHDF实验中。
图7D显示了在XbaIR基因转染或空转染之后,相对于NHDF细胞中的核β-肌动蛋白水平,通过人12S rRNA的qPCR估计的线粒体DNA拷贝数的定量。将线粒体转移至指明的受体细胞中。XbaIR导致线粒体DNA显著减少,这可以通过外源线粒体转移挽救。(n=3)
图7E显示了7SP对照受体细胞(SEQ ID NO:14)、EPC100对照供体细胞(SEQ ID NO:12)、无线粒体替换的7SP来源的ρ(-)细胞(SEQ ID NO:13)和具有线粒体替换的7SP来源的ρ(-)细胞(SEQ ID NO:15)中围绕hmt10158的核苷酸的DNA测序数据,并且表明7SP对照细胞是异质的(大多数是10158C;SEQ ID NO:14),然而EPC100仅在线粒体DNA中的相同位点具有T(SEQ ID NO:12)。源自7SP细胞的ρ(-)细胞表达与原始相同的波(SEQ ID NO:13),然而线粒体替换的7SP细胞作为主波显示T(SEQ ID NO:15)。
图7F显示了用于围绕hmt10158处的Leigh综合征相关SNP的人线粒体DNA的ND3(SEQ ID NO:16)的扩增的hmt10085-F(SEQ ID NO:17)和hmt10184-R(SEQ ID NO:20)引物组,以及设计用于TaqMan SNP基因分型测定的EPC100特异性探针(SEQ ID NO:18)和7SP特异性探针(SEQ ID NO:19)。还显示了ND3肽序列(SEQ ID NO:46)。
图7G显示了通过SNP测定评价的每个细胞组中的hmt10158异质性百分比的定量,并且显示在线粒体替换的7SP细胞中以外源正常序列(“健康”)为主并高达80%,即使突变体序列的原始异质性超过90%。在空转染子的情况下,异质性未显著变化并且维持几乎相同的比值。
图7H和图7I在用空对照处理并进行线粒体转移的7SP细胞中,在3个独立实验中显示了异质性水平百分比(图7H)和绝对mtDNA拷贝数(图7I)的定量。
图7J显示了垂直按时间顺序布置的来自图7G中所示的时间间隔拍摄的一系列10幅静止图像。
图8A显示了与原始7SP成纤维细胞和ρ(-)7SP成纤维细胞相比,ρ(-)线粒体替换的7SP成纤维细胞随时间的显微照片,并且显示线粒体替换的细胞的生长恢复至接近对照水平。
图8B显示了7SP成纤维细胞、ρ(-)7SP成纤维细胞和具有线粒体替换的ρ(-)7SP成纤维细胞中时间推移估计的细胞生长,然而线粒体替换的7SP细胞在约第12天使细胞生长恢复至相当于原始7SP成纤维细胞的水平。
图8C显示了群体倍增水平(PDL)约25的7SP成纤维细胞中的衰老,这在具有PDL 8时实施的健康线粒体替换的ρ(-)7SP成纤维细胞中延长至约PDL 63,表明具有健康线粒体替换的ρ(-)7SP成纤维细胞的寿命延长。
图8D显示PDL的增加产生了细胞尺寸增加(左图),这在线粒体替换后恢复并且维持甚至超过PDL 50(右图)。
图8E显示了短串联重复序列(STR)测定,其区分了具有不同来源的细胞并且鉴别了不同类型的细胞的污染。在不同时间点,线粒体替换的细胞中的STR类型与原始7SP成纤维细胞中的完全相同。
图8F显示了相对于HeLa和EPC100,对于不同的PDL,7SP成纤维细胞和线粒体替换的细胞中端粒酶的RT-PCR定量,从而表明所述细胞未转化为癌细胞。
图9A显示了在根据耦合-控制规程(coupling-control protocol,CCP),使用Oroboros O2k的线粒体替换后,在不同的PDL,7SP成纤维细胞中的氧气描记,并且动力学表明相对于作为对照的原始7SP成纤维细胞,在早期PDL,线粒体功能降低,然后缓慢恢复并最终超过原始能力。
图9B和图9C显示在约PDL30之后,在线粒体替换的细胞(ρ(-)Mt)中,呼吸流量(常规,电子传递体系(Electron Transfer System,ETS),ROX)、游离常规活性(线粒体ATP产生)、质子泄露和耦合效率(图9B)以及通量控制比(FCR)、ROX/E、L/E、R/E和(R-L)/E(图9C)恢复至接近对照水平。
图10A显示了在基础条件下或者在使用H2O2的再灌注之后,NHDF、7SP、7SP MirC细胞的显微镜图象,并且显示相对于NHDF细胞,7SP细胞对H2O2高度灵敏,然而7SP MirC不是。
图10B-图10D显示了在不处理或者用H2O2处理后,膜联蛋白V(图10C)和碘化丙啶(PI;图10D)阳性细胞的FACS分析(图10B)和定量,并且显示相对于NHDF细胞,7SP细胞对H2O2高度灵敏,然而7SP MirC不是。
图10E显示了在基础条件下或者在饥饿条件(EAA-)后,NHDF、7SP、7SP MirC细胞的显微镜图象,并且显示相对于NHDF细胞,7SP细胞对饥饿条件高度灵敏,然而7SP MirC不是。
图10F-图10H显示了在不处理或饥饿处理后,膜联蛋白V(图10G)和PI(图10H)阳性细胞的FACS分析(图10F)和定量,并且显示相对于NHDF细胞,7SP细胞对饥饿条件高度灵敏,然而7SP MirC不是。
图11显示了PDL几乎相同(约15至20)的NHDF、7SP成纤维细胞和7SP成纤维细胞-来源的MirC细胞的代表性SASP细胞因子IL-6和IL-8、趋化因子CXCL-1和生长因子ICAM1的表达水平的定量,其表明IL-6显著降低,表明MirC中SASP的逆转。将GAPDH用于归一化。
图12A显示了来自线粒体替换的7SP成纤维细胞的诱导的多潜能干细胞(iPSC)的产生方案。
图12B-图12D显示了作为iPSC的指示剂的碱性磷酸酶(AP)染色和定量,它是从7SP成纤维细胞、7SP成纤维细胞-来源的MirC或来源于7SP成纤维细胞的空转染子产生的。AP染色细胞的微观(图12B左图;7SP成纤维细胞,中间图;7SP成纤维细胞-来源的MirC,右图:7SP成纤维细胞的空转染子)和宏观(图12C左图;7SP成纤维细胞,中间图;7SP成纤维细胞-来源的MirC,右图:7SP成纤维细胞的空转染子)显微镜以及AP染色细胞的定量(图12D)显示在XbaIR处理后,NHDF或7SP成纤维细胞中的线粒体替换导致AP染色升高。
图12E显示了来源于线粒体替换的7SP成纤维细胞的iPSC的集落形成。在重编程因子的基因转移后75天和170天的3个代表性集落的照片。
图12F显示了在线粒体替换后,从7SP成纤维细胞产生的iPSC中的OCT3/4、NANOG、TRA1-80和TRA-160的免疫组织化学染色,它是多潜能干细胞的代表性标志物;
图12G显示了与作为参考的原始7SP成纤维细胞和标准人iPSC(201B7)相比,来源于7SP成纤维细胞来源的MirC的iPSC中的线粒体DNA拷贝数,并且显示iPSC具有与标准人iPSC的类似的有限的线粒体DNA个数。
图12H和图12I显示了在重编程程序后170天,在来源于7SP成纤维细胞-来源的MirC的iPSC中的异质性百分比(图12H)和绝对mtDNA拷贝数(图12I),并且显示形成iPSC的7SP成纤维细胞-来源的MirC在至少3个克隆中显示出可忽略的水平的突变基因组序列,降低的总mtDNA和接近100%的供体mtDNA,表明MirC中的异质性变化可以恢复至原始状态,并且不同于IVF中的线粒体替换疗法。
图13A显示了从供体细胞向受体细胞的线粒体转移的规程方案,其中所述供体细胞和受体细胞来自生命周期的不同阶段。
图13B显示了具有基因型hmt16145 A的NHDF对照受体细胞(SEQ ID NO:21)和具有基因型hmt16145 G的TIG1对照供体细胞(SEQ ID NO:22)中围绕hmt16145的核苷酸的DNA测序数据。
图13C显示了通过来自线粒体替换的细胞(MirC)(具有来自“年轻”TIG1供体细胞的线粒体的线粒体转移的“老”NHDF受体细胞)的细胞的SNP测定的hmt16145异质性水平(%)定量,并且表明具有来自TIG1来源的线粒体供体细胞的线粒体替换的NHDF来源的MirC细胞中的大于90%的mtDNA是hmt16145 G(即来自TIG1 mtDNA),然而100%的NHDF对照细胞的mtDNA是hmt16145 A。
图13D显示了在用MTS-GFP(“空”)或MTS-XbaIR(“MirC”)转染并且与来自TIG1供体细胞的外源线粒体共培育的受体NHDF细胞或者未转染的受体NHDF细胞(“对照”)中,群体倍增水平(PDL)相对于时间(天)(左图)和倍增时间(小时)相对于群体倍增水平(右图)的定量。具有“年轻”供体TIG1胚胎肺细胞(PDL 10)对“老”的正常人皮肤成纤维细胞(NHDF)受体细胞(PDL 41)的替换的MirC显示出寿命延长,如通过PDL中的向上偏移(左图)和PDL中的向右偏移(右图)所示。
图13E显示了在用MTS-GFP加线粒体转移(“空”)或MTS-XbaIR加线粒体转移(“MirC”)转染的正常人皮肤成纤维细胞或者未转染的正常人皮肤成纤维细胞(“对照”)中,群体倍增水平(PDL)相对于时间(天)(左图)和倍增时间(小时)相对于群体倍增水平(右图)的定量。从“老”供体细胞(PDL 49)向“年轻”受体细胞(PDL<21)的线粒体转移显示出寿命缩短,如通过PDL中的向下迁移(左图)和PFL中的向左迁移(右图)所示。
图14A显示了通过体外转录所产生的mRNA的质量评价,如通过对MTS-EGFP和MTS-XbaIR的mRNA的电泳所测量的。
图14B显示在电穿孔后24小时,T细胞的线粒体中MTS-GFP转基因强表达。
图14C显示了在通过电穿孔的MTS-GFP mRNA的转染后,T细胞中GFP表达的FACS分析,并且显示GFP表达存在于几乎所有的T细胞中。
图14D显示了DsRed标记的线粒体的FACS分析,并且表明MTS-XbaIR构建体稳健地降解内源线粒体,然而MTS-GFP不会。
图14E显示了用于确定线粒体共培育的最优时间段的规程设计方案。
图14F显示了对照电穿孔细胞(上图)和MTS-GFP电穿孔细胞(下图)在电穿孔(EP)后4小时、2天、4天、6天和8天时的荧光图像,并且表明在电穿孔后4小时内,MTS-GFP构建体显示出高表达并且到第6天时,几乎不存在。
图14G和图14H显示了相对于GAPDH,在接收MTS-GFP mRNA的细胞中GFP的电泳(图14H)和定量(图14G)。峰值表达发生在第4天,并且到第6天时,表达消失。
图14I显示了4小时、第2天(d2)、第4天(d4)、第6天(d6)和第8天(d8)时XbaIR转录本水平的定量,其表明核酸内切酶的转录本表达在基因转移后4小时是最高的。
图14J显示了经受MTS-XbaI的细胞中线粒体含量的定量(12S rRNA)并且表明到第2天,线粒体减少至约30%,并且在整个实验长度内,保持在小于20%。
图15A显示了在第0天进行电穿孔,在第2天分析,在第7天进行线粒体(mt)转移,在第9和14天进行SNP测定并且在第14天进行ddPCR异质性测定的人原代T细胞的MirC规程方案。
图15B显示了人原代NH T细胞对照受体细胞(顶部;SEQ ID NO:23)和EPC100对照供体细胞(底部;SEQ ID NO:24)中人线粒体DNA D-环的HV1区的hmtDNA 218和hmtDNA 224周围的核苷酸的DNA测序数据。对于T细胞和EPC100细胞,hmtDNA 218和hmtDNA 224分别是C/C(SEQ ID NO:23)和T/T(SEQ ID NO:24)。
图15C显示了用于围绕hmtDNA 218和hmtDNA 224处的SNP的人线粒体DNA D-环(SEQ ID NO:25)的HV1区的扩增的hmtHV1-F(SEQ ID NO:26)和hmtHV1-R(SEQ ID NO:27)的引物组,以及SNP测定引物Primer1-F(SEQ ID NO:40)、SNP测定-引物Primer1-R(SEQ IDNO:41),设计用于TaqMan SNP基因分型测定的N末端VIC标记的EPC100特异性探针(SEQ IDNO:38)和N末端FAM标记的T细胞特异性探针(SEQ ID NO:39)。
图15D显示了在与来自供体EPC100细胞的外源线粒体共培育后,对于空(MTS-GFP)或MTS-XbaIR(XbaIR)处理的细胞,在第7天和第12天存在于受体细胞中的外源mtDNA的量的定量。作为阳性对照进行受体和供体细胞的定量。
图15E显示了使用Oroboros O2k进行的呼吸测量实验的定量,并且表明了人T细胞-来源的MirC中的ATP产生和耦合效率的恢复,然而通过使用电穿孔的XbaIR mRNA转移所产生的ρ(-)人T细胞在整个实验期间维持ATP产生的丧失。
图15F和图15G显示了使用耦合-控制规程(CCP)的代表性原始数据,并且显示MirCT细胞能够恢复线粒体呼吸。
图16A显示了在RPMI1640(顶部)或TexMACS(底部)中培养的小鼠原代T细胞在第2天(左图左侧),第4天(左图中间)和第6天(左图右侧)的存活力比较(左图)或者CD3表达(右图),并且表明相对于TexMACS培养基,RPMI1640产生了更大的存活力和更高的细胞计数,以及轻微的CD3表达升高。
图16B显示了在电穿孔(EP)后,使用pmax GFP(中间)或MTS-GFP(右图)或者无电穿孔(左图)的T细胞中,在EP后6小时(左上图),EP后2天(右上图),EP后4天(左下图)和EP后6天(右下图)的GFP表达的定性分析。在EP后2天或4天,使用MTS-GFP不显著影响存活力。
图16C显示了在电穿孔后4小时、2天、4天和6天时,使用MTS-XbaIR载体的电穿孔T细胞中的XbaIR水平的qPCR定量,并且表明XbaIR表达缓慢降低。
图16D显示了使用MTS-XbaIR,在电穿孔T细胞中12S rRNA水平的定量,并且表明到第4天,鼠科mtDNA减少约60%。
图16E显示了使用线粒体共培育,在第5天,在T细胞中用于MirC产生的规程方案。
图16F显示了在与分离的DsRed-标记的线粒体共培育后48小时,受体T细胞中吞没的DsRed-标记的线粒体的FACS分析,并且显示了与无电穿孔的对照细胞(即“附加”)中的0.43%相比,MTS-XbaIR中表达外源线粒体的T细胞的明显的阳性部份(9.73%)。
图17A显示了具有基因型mmt2766-A和mmt2767-T的小鼠mtDNA C57BL6受体细胞(“BL6”;顶部;SEQ ID NO:34)和具有基因型mmt2766-G和mmt2767-C的NZB供体细胞(底部;SEQ ID NO:35)中围绕ND1的核苷酸的DNA测序数据。
图17B显示了用于围绕多态性核苷酸mmt2766和mmt2767的小鼠线粒体DNA的ND1(SEQ ID NO:32)的扩增的2716-F(SEQ ID NO:28)和2883-R(SEQ ID NO:33)的引物组,和设计用于TaqMan SNP基因分型测定的BL6特异性探针(SEQ ID NO:29)和NZB特异性探针(SEQID NO:31),以及在用于产生能够绝对定量的标准曲线的质粒中用于克隆核苷酸序列的BamH1-mND1-F引物(SEQ ID NO:30)。还显示了ND1肽序列(SEQ ID NO:47)。
图17C显示了对照电穿孔后(分别为第1和2列)或者MTS-XbaI电穿孔并与来自NZB细胞的分离的线粒体共培育后7天和12天(分别为第3和4列),在BL6受体细胞中的小鼠mtND1异质性水平的定量。作为对照测量了BL6(第5列)和NZB(第6列)细胞的基础水平。
图17D显示了在用MTS-XbaIR mRNA对老的鼠科细胞进行处理并与来自年轻供体细胞的外源线粒体共培育以产生MirC(年轻至老:YtoO)后,端粒长度的测量,并且表明与亲代“老”细胞相比,MirC中的端粒长度增加。
图17E显示了亲代老T细胞或者MirC-来源的T细胞中SASP相关细胞因子CXCL1、ICAM1、IL-6和IL-8的测量,并且表明在MirC-来源的T细胞中CXCL1和IL6较少。
图17F显示了使用组蛋白2A(H2A)磷酸化抗体,在MirC和原始T细胞中的DNA损伤应答的测量,其表明与原始T细胞(4.75%)相比,MirC中的DDR阳性部份较低(1.53%)。
图18A显示了使用具有来自年轻小鼠的T细胞的ACT的老小鼠(组1)、具有ACT的老小鼠(组2)或者具有来源于转移了来自年轻小鼠的外源线粒体的老小鼠的T细胞的MirC的ACT的老小鼠(组3)的体内ACT实验方案。
图18B显示了在实验规程期间实施的肿瘤生长成像的代表性图像。
图18C显示了空、年轻T细胞或MirC组的体重,并且表明在25天实验期间,在3组之间未观察到显著差异。
图18D和图18E显示了个体(图18D)和平均(图18E)癌症物质尺寸的定量并且表明MirC组将癌症物质尺寸降低至相当于年轻T细胞组的水平(下线),然而在整个实验长度期间,空组中的癌症物质增加(上线)。
图18F显示了用于分析动物中输注的T细胞的存在的规程方案。
图18G显示了周围血液(左图)或脾脏(右图)的FACS分析。对于周围血液和脾脏两者产生了使用C57BL/6小鼠的阴性对照(左上图)和使用GFP转基因小鼠的阳性对照(左下图)。在周围血液和脾脏两者中识别了表达GFP荧光的T细胞的阳性部份,其分别为0.057%和0.9%。
图18H显示了在移植后第6天,在小鼠中检测的转移的T细胞的免疫荧光图象。
图18I显示了在注入1×107或2×107个细胞后,在周围血液(PB)或脾脏中输注外源T细胞后的嵌合性百分比。
图19A和图19B显示了使用X-001、Y-001和T-030程序(分别为MTS-GFP1、2和3)或者作为阳性对照的pmax GFP或者作为阴性对照的Ctl EP,通过显微镜学(图19A)或者FACS(图19B)对MTS-GFP向造血细胞(HSC)的转染的评价,并且显示MTS-GFP1是用于电穿孔HSC的最优规程。
图19C显示了在与来自EPC100细胞的DsRed-标记的线粒体共培育后48小时,骨髓-来源的Sca-1细胞的三维共聚焦荧光成像,并且显示吞没了外源线粒体。
图19D显示了通过DsRed荧光的FACS分析的线粒体转移效率的定量,并且显示约10%的Sca-1亚群显示出荧光的向右迁移。
图19E显示了通过在第4天与外源线粒体共培育并且在第6天通过SNP测定分析MirC的用于产生HSC来源的MirC的方案。
图19F显示了细胞的c-kit+、Sca-1+、系谱-、CD34-(称为KSLC)部份的FACS分选。
图19G显示KSLC部份的倍增时间是19小时。
图19H显示了用于评价HSC来源的MirC的方案。
图19I显示了鼠科KSLC-来源的MirC或者亲代受体BL6细胞或NZB供体细胞中鼠科mtND1异质性水平百分比的定量,并且表明在通过电穿孔的MTS-XbaI mRNA转移后6天,MirC来源的HSC表达99.9%的供体细胞的多态性基因型。
图20A显示了其中在正常人皮肤成纤维细胞中分析了突变的mtDNA和非突变的mtDNA序列的tRNA Leu 3243 A>G的微滴式数字PCR结果的2-D图,并且仅显示检测到非突变的序列(右下象限)并且未检测到突变序列(左上象限)。
图20B显示了其中在正常人皮肤成纤维细胞中分析了突变的mtDNA和非突变的mtDNA序列的ND3 10158 T>C的微滴式数字PCR结果的2-D图,并且仅显示检测到非突变的序列(右下象限)并且未检测到突变序列(左上象限)。
图20C显示了其中在正常人皮肤成纤维细胞中分析了突变的mtDNA和非突变的mtDNA序列的ATP6 9185 T>C的微滴式数字PCR结果的2-D图,并且仅显示检测到非突变的序列(右下象限)并且未检测到突变序列(左上象限)。
图20D显示了其中在来自患有具有mtDNA A3243G突变的MELAS的患者的原代皮肤成纤维细胞中分析了突变mtDNA和非突变mtDNA序列的微滴式数字PCR结果的2-D图,并且显示大部分细胞具有突变mtDNA的同型异源性(左上象限)。
图20E显示了其中在来自患有具有复合物I,ND3基因的mtDNA T10158C突变的Leigh综合征的患者的原代皮肤成纤维细胞中分析了突变mtDNA和非突变mtDNA序列的微滴式数字PCR结果的2-D图,并且在单细胞水平显示了具有异质性的较少部分的双重阳性细胞(右上象限),并且显示大部分群体具有突变mtDNA的同型异源性(右下)并且无群体具有非突变mtDNA的同型异源性(左上)。
5.发明的详细说明
本文提供了不需要完全除去内源mtDNA并且可以任选地使用与临床使用相容的试剂进行的产生线粒体替换的细胞(MirC)的新型和增强的方法。另外,在某些实施方式中,本文提供了治疗方法,其包括施用治疗有效量的使用本文所提供的方法产生的MirC。
还提供了包含通过本文所提供的方法获得的一种或多种线粒体替换的细胞的组合物。在某些实施方式中,所述组合物还可以包含提高外源线粒体、外源mtDNA或它们的组合的吸收的第二活性剂和/或减少内源mtDNA拷贝数的试剂或者降低内源线粒体功能的试剂。在其它实施方式中,所述组合物还可以包含外源线粒体和/或外源mtDNA、一种或多种受体细胞或它们的组合。在一个具体实施方式中,本文提供了用于在治疗与功能障碍的线粒体有关的疾病或病症中使用的方法和组合物。然而,应理解本文所提供的方法和组合物还可以用于延缓具有功能性线粒体的细胞的衰老,延长其寿命或增强其功能,并且不局限于功能障碍的线粒体的替换。此外,本文所提供的方法和组合物还可以用于用功能障碍或耗竭的外源线粒体替换功能性线粒体(例如)以产生疾病模型。
5.1定义
除非另外具体定义,否则在本发明申请中使用的所有术语,包括技术和科学术语具有与本发明所属领域的技术人员通常理解的含义相同的含义。通常,在本说明书和以下所述的实验方法中使用的命名是相关领域中普遍已知且通常使用的。
如本文所使用的,术语“线粒体替换的细胞”或MirC旨在表示具有外源线粒体和/或mtDNA对内源线粒体和/或mtDNA的替换的细胞。例如,示例性的线粒体替换的细胞(MirC)包括用编码功能性线粒体的外源mtDNA,如来源于健康对象的mtDNA替换编码功能障碍的线粒体的内源mtDNA,如来源于患有线粒体疾病或病症的对象的mtDNA。示例性的MirC还可以包含用外源线粒体替换内源线粒体的细胞。然而,应理解内源线粒体和/或mtDNA的替换还可以包括(例如)用来自不同细胞,如来自年轻对象的更健康的细胞的功能性外源mtDNA替换来自一种细胞,如来自年老细胞的功能性内源mtDNA。还将理解还可以用功能障碍的外源线粒体和/或外源mtDNA替换健康的内源线粒体和/或mtDNA,如(例如)模拟线粒体疾病或病症。替换不需要导致细胞中所有内源线粒体的完全替换,并且示例性的线粒体和/或mtDNA替换包括约5%或以上,约10%或以上,约20%或以上,约30%或以上,约40%或以上,约50%或以上,约60%或以上,约70%或以上,约80%或以上,约90%或以上或者约95%或以上的内源线粒体和/或mtDNA的替换。
如本文所使用的,术语“受体细胞(recipient cell)”、“受体细胞(acceptorcell)”和“宿主细胞”是可互换的并且表示接收外源线粒体和/或mtDNA的细胞。在一些实施方式中,外源线粒体和/或mtDNA来自分离的线粒体,所述分离的线粒体来自供体细胞。在一些实施方式中,所述供体细胞和所述受体细胞可以是不同的或相同的。在一些实施方式中,所述供体细胞和所述受体细胞来自不同或相同的物种。在一些实施方式中,所述供体细胞和所述受体细胞来自不同或相同的组织。
如本文所使用的,术语“健康供体”旨在表示未患有线粒体疾病或病症、年龄相关疾病或其它功能障碍的线粒体的供体。在优选的实施方式中,相对于线粒体基因组的剑桥参考序列,健康供体具有野生型mtDNA序列。
如本文所使用的,术语“治疗”表示症状严重程度、发展、扩散和/或频率的降低、症状和/或潜在原因的消除、发生症状和/或它们的潜在原因的预防以及伤害的改善或补救。“治疗”表示包括病况、疾病或病症的治疗性治疗以及预防或抑制措施。
当用于表示消除、减少mtDNA时,如本文所使用的,术语“试剂”是指能够减少mtDNA的酶或化合物。优选的试剂包括限制性内切酶,如XbaI,其在一个或多个位点切割mtDNA,而不会在受体细胞中产生毒性。然而,试剂还可以包括抑制mtDNA合成或者选择性促进线粒体降解的酶或化合物。
如本文所使用的,术语“减少”或“降低”通常是指与参考水平相比,至少5%的降低,例如,至少约10%,或者至少约20%,或者至少约30%,或者至少约40%,或者至少约50%,或者至少约60%,或者至少约70%,或者至少约80%,或者至少约90%的降低,或者5%-99%之间的任何降低,如该术语在本文中所定义的。如本文所使用的,应理解部分减小或者部分减小内源mtDNA的试剂或者降低不导致所有内源mtDNA的完全消除(即ρ0细胞)。如本文所使用的术语“升高”通常表示至少5%的升高,例如,至少约10%的升高,或者至少约20%,或者至少约30%,或者至少约40%,或者至少约50%,或者至少约60%,或者至少约70%,或者至少约80%,或者至少约90%,或者大于90%的升高。
如本文所使用的,术语“内源的”是指内部产生或来源的。例如,内源线粒体是细胞天然的线粒体。
如本文所使用的,术语“外源的”是指对于宿主是非天然的细胞材料(例如,线粒体或mtDNA),如外部来源的细胞材料。“外部”通常表示来自不同来源。例如,当线粒体基因组来源于与宿主细胞或宿主线粒体相比不同的细胞类型或不同的物种时,线粒体基因组对于宿主细胞或宿主线粒体是外源的。另外,“外源的”还可以表示从线粒体除去、操纵并返回相同线粒体的线粒体基因组。
如本文所使用的,术语“足够的一段时间”是指生产所期望的结果的时间量。应理解足够的一段时间将根据实验条件而改变,其包括(但不限于)温度、所使用的试剂的量和细胞类型。作为指导,在全文中为“足够的一段时间期间”提供了示例性规程,并且本领域技术人员将能够识别足够的一段时间而无需过度实验。
如本文所使用的,术语“大多数”旨在表示相对于所比较的另一个量的最大的量。当对两组进行比较时,示例性的大多数是全部群体的大于约50%或以上,约60%或以上,约70%或以上,约80%或以上,或者约90%或以上,或者约95%或以上的任何整数的量,包括它们之间的任何整数的量。应理解大多数将取决于所比较的总群体,并且当存在3个或更多个比较的组时,可以是小于50%的量。
当用于表示外源材料的转移时,如本文所使用的,术语“无创”旨在表示不使用创伤性仪器(例如,纳米刀片或电穿孔)、物理作用力(例如,离心作用)或者有害培养条件(例如,热冲击)。在优选的实施方式中,无创转移程序包括受体细胞和供体线粒体的共培育。
如本文所使用的,术语“需要线粒体替换的对象”旨在表示已经或倾向于具有功能障碍的线粒体的对象。需要线粒体替换的对象可以是无症状的并且需要预防性护理。需要线粒体替换的对象还可以是有症状的并且需要治疗。在某些实施方式中,需要线粒体替换的对象具有不是由于年龄相关疾病或线粒体疾病或病症所造成的功能障碍的线粒体。
如本文所使用的,术语“对象”旨在表示哺乳动物。对象可以是人或非人哺乳动物,如狗、猫、牛、马、小鼠、大鼠、兔或其转基因物种。应理解“对象”还可以表示“患者”,如人患者。
如本文所使用的,术语“有效量”是指对于调节、治疗或改善与异质性和/或功能障碍的线粒体有关的任何疾病或病症有效的本发明的组合物的量。照此,有效量可以包括(例如)治疗有效量,其是指疗法有效量或者生物学有效量,其是指对于生物效应有效的量。术语“治疗有效量”和“有效量”可以涵盖改善整体疗法,减少或避免疾病或病症的症状或病因或者提高另一种治疗剂的治疗效力的量。将对应于这种量的给定组合物的量将根据多种因素而改变,如给定组成、药物制剂、施用途径、病况、疾病或病症的类型、正在治疗的对象或宿主的身份,但是尽管如此本领域技术人员可以常规地确定这些因素。如本文所定义的,技术人员可以通过本领域中已知的常规方法容易地确定试剂的治疗有效量。
如本文所使用的,术语“年龄相关疾病”是指可归因于年龄增长的多种病况。这些病况包括但不限于骨质疏松症、骨流失、关节炎、关节硬化、白内障、黄斑变性、代谢疾病,包括糖尿病、神经退行性疾病,包括阿尔茨海默氏病和帕金森氏症、免疫衰老和心脏病,包括动脉粥样硬化和血脂异常。短语“年龄相关疾病”还涵盖了神经退行性疾病,如阿尔茨海默氏病和相关病症、ALS、亨廷顿病、帕金森氏病和癌症。
如本文所使用的,术语“自体免疫疾病”旨在表示由针对自身组织、器官的免疫反应所产生的疾病或病症,或其表现或者由此产生的病况。自体免疫疾病可以表示由与自体免疫抗原或其表位具有反应性的自体抗体的产生所造成或加重的病况。自体免疫疾病可以是组织-或器官-特异性的,或者它可以是全身性自体免疫疾病。全身性自体免疫疾病包括结缔组织疾病(CTD),如全身性红斑狼疮(狼疮;SLE)、混合结缔组织病系统性硬化、多肌炎(PM)、皮肤肌炎(DM)和干燥综合征(SS)。其它示例性自体免疫疾病还包括类风湿性关节炎和抗中性粒细胞胞质抗体(ANCA)多血管炎。
如本文所使用的,术语“遗传疾病”是指由核基因组异常,如突变所引起的疾病。示例性的遗传性疾病包括(但不限于)早年衰老综合症、沃纳综合征和亨廷顿病。
如本文所使用的,术语“癌症”包括(但不限于)实体癌和血液扩散的癌症。术语“癌症”和“癌性的”表示或描述了其特征通常为无限制的细胞生长的哺乳动物中的生理条件。
如本文所使用的,术语“线粒体疾病或病症”和“线粒体病症”是可互换的并且表示由遗传性或获得性线粒体损害所造成的一组病况,其导致身体那些区域内能量短缺。受线粒体疾病或病症影响的示例性器官包括消耗大量能量的那些器官,如肝脏、肌肉、脑、眼、耳和心脏。结果通常是肝功能衰竭、肌无力、疲劳以及心脏、眼和多种其它系统的问题。
如本文所使用的,术语“线粒体DNA异常”表示线粒体基因中的突变,其产物定位至线粒体,但在健康对象细胞中观察不到。与线粒体DNA异常有关的示例性疾病包括(例如)慢性进行性眼外肌麻痹(CPEO)、皮尔逊综合症、科恩-塞亚综合征(Kearns-Sayre Syndrome)(KSS)、糖尿病伴耳聋(DAD)、Leber遗传性视神经病变(LHON)、LHON-加、神经病、共济失调和视网膜色素变性综合征(NARP)、母系遗传的Leigh综合征(MILS),也称为由突变mtDNA所引起的Leigh综合征、线粒体脑肌病、乳酸性酸中毒和中风样发作(MELAS)、肌阵挛性癫痫伴碎红纤维病(MERRF)、家族性双侧纹状体坏死/纹状体黑质变性(FBSN)、Luft病、氨基糖苷引起的耳聋(AID)和线粒体DNA综合征的多种缺失。
在线粒体疾病或病症的背景中,如本文所使用的,术语“核DNA异常”表示其产物定位至线粒体的核基因编码序列的突变或变化。与核突变有关的示例性线粒体疾病或病症包括线粒体DNA缺失综合征-4A、线粒体隐性共济失调综合征(MIRAS)、线粒体神经胃肠道脑肌病(MNGIE)、线粒体DNA缺失综合征(MTDPS)、DNA聚合酶γ(POLG)-相关病症、感觉性共济失调性神经病伴构音障碍及眼肌麻痹(SANDO)、伴脑干与脊髓受累以及乳酸升高的脑白质病(LBSL)、辅酶Q10缺乏症、Leigh综合征(由核突变引起)、线粒体复合物异常、延胡索酸酶缺乏症、α-酮戊二醛脱氢酶复合物(KGDHC)缺乏症、琥珀酰辅酶A连接酶缺乏症、丙酮酸脱氢酶复合物缺乏症(PDHC)、丙酮酸羧化酶缺乏症(PCD)、肉毒碱棕榈酰转移酶I(CPT I)缺乏症、肉毒碱棕榈酰转移酶II(CPT II)缺乏症、肉碱-酰基-肉碱(CACT)缺乏症、常染色体显性-/常染色体隐性-进行性眼外肌麻痹(ad-/ar-PEO)、婴儿型脊髓小脑萎缩(IOSCA)、线粒体肌病(MM)、脊髓性肌萎缩(SMA)、生长停滞、氨基酸尿、胆汁郁积、铁过载、早期死亡(GRACILE)和2A型Charcot-Marei-Tooth病(CMT2A)。
如本文所使用的,术语“功能障碍的线粒体”表示与功能性线粒体相对的线粒体。示例性功能障碍线粒体包括通过氧化磷酸化不能合成ATP或合成的ATP的量不足的线粒体。如本文所使用的,术语“功能性线粒体”是指消耗氧气并产生ATP的线粒体。
如本文所使用的,术语“突变”是指基因结构的任何改变,其导致产生了变体(也称为“突变体”)形式。基因突变可以由DNA中单个碱基的交替或者由较大的基因区或染色体的缺失、插入或重复引起。在一些实施方式中,所述突变可以影响功能或者所产生的蛋白。例如,蛋白编码区中的DNA单核苷酸突变(即点突变)可以导致产生编码不同氨基酸的密码子(即错义突变)。应理解这种不同的氨基酸可以改变蛋白结构并且在某些情况下,如本文所述,可以改变细胞器,如线粒体的功能。
如本文所使用的,术语“异质性”和“异质的”表示个体或样品中不止一种类型的线粒体DNA基因组的出现。不同程度的异质性与本文所述的不同程度的生理条件有关。可以通过本领域已知的方式鉴别异质性,并且预期与特定核苷酸等位基因有关的生理条件的严重程度将随个体内这种相关等位基因的百分比而改变。
当在线粒体DNA的背景中使用时,如本文所使用的,术语“野生型”是指如它在自然界中存在的典型物种形式的基因型。野生型人mtDNA基因组的示例性参考基因组包括剑桥参考序列(CRS)。
如本文所使用的,术语“老”或“较老”旨在表示mtDNA的来源来自年龄比受体细胞更大的对象或者相对于受体细胞,来自自它们离体培养起,群体倍增次数(即群体倍增水平,PDL)更大的细胞群体中的细胞。
如本文所使用的,术语“年轻”或“较年轻”旨在表示mtDNA的来源来自年龄比受体细胞更小的对象或者相对于受体细胞,来自自它们离体培养起,它们的群体倍增次数(即群体倍增水平,PDL)更少的细胞群体中的细胞。
当用于表示线粒体时,如本文所使用的,术语“分离的”是指已与其天然生物环境的其它细胞组分物理分离或从中除去的线粒体。
如本文所使用的,术语“完整的”和“完整的线粒体”是指包含外膜和内膜、膜间腔、嵴(由内膜形成)和基质的线粒体。示例性的完整线粒体含有mtDNA。在优选的实施方式中,完整的线粒体是功能性线粒体。然而,应理解还可以在本发明中使用完整的功能障碍的线粒体。
如本文所使用的,术语“自体同源的”旨在表示得自相同对象的生物成分。
如本文所使用的,术语“同种异体的”旨在表示得自相同物种,但是基因型与接受所述生物成分的对象的不同的生物成分。
如本文所使用的,术语“动物细胞”旨在表示来自真核生物的任何细胞。应理解动物细胞可以包括哺乳动物和非哺乳动物物种,如两栖动物、鱼、昆虫(例如,果蝇(Drosophila))和虫(例如,秀丽隐杆线虫(Caenorhabditis elegans))。
如本文所使用的,术语“融合蛋白”是指主要但不必需通过肽键彼此连接的氨基酸序列,其中所述序列的一部分来源于(即与序列具有序列相似性)一种来源(天然或合成),而所述序列的另一部分来源于一种或多种其它来源。可以通过构建编码整个融合蛋白(编码两个部分,如线粒体-靶向序列和核酸内切酶)的表达载体来制备示例性融合蛋白,从而基本上所有的键是肽键。还将理解可以通过化学缀合,如通过使用用于缀合肽的任何已知方法来进行融合。
如本文所使用的,术语“线粒体-靶向序列(MTS)”和“线粒体靶向序列(MTS)”是可互换的并且表示能够导致与之连接的酶、肽、序列或化合物转运至线粒体中的任何氨基酸序列。在某些实施方式中,所述MTS是人MTS。在另一个实施方式中,所述MTS来自另一个物种。这些序列的非限制性实例是细胞色素c氧化酶亚基X(COX10)MTS(MAASPHTLSSRLLTGCVGGSVWYLERRT,SEQ ID NO:36)和细胞色素c氧化酶亚基VIII(COX8)MTS(MSVLTPLLLRSLTGSARRLMVPRA,SEQ ID NO:37)。MTS序列的其它非限制性实例是通过核DNA编码、在细胞质中翻译(产生)并转运到线粒体中的每个单个线粒体蛋白的天然MTS以及柠檬酸合酶(cs)、硫辛酰胺脱氢酶(LAD)和C6ORF66(ORF)。在它们当中,多种MTS对于每种线粒体酶可以是可交换的。每种可能性代表了用于本发明使用的融合蛋白的单独的实施方式。
如本文所使用的,术语“小分子”是指影响生物过程并且分子量为约900道尔顿或以下的化合物。示例性的小分子的分子量在约300至约700道尔顿之间。
当结合数值使用时,如本文所使用的,术语“约”或“大约”表示所提及的数值的1、5、10、15或20%以内的任何数值。
如本文所使用的,术语“体细胞”是指除干细胞、祖细胞和生殖细胞(即卵原细胞和精原细胞)以及由此衍生出的细胞(例如,卵母细胞、精子)外,形成生物体的任何分化的细胞。例如,内脏、皮肤、骨、血液和结缔组织均由体细胞组成。体细胞得自动物,优选地人对象,并且根据本领域那些技术人员可用的标准细胞培养规程培养。
如本文所使用的,术语“内吞途径”是指其中细胞从它们周围吸收分子的细胞过程。内吞途径可以是“内涵素-依赖性的”,其需要招募内涵素来帮助质膜弯曲至吸收所述分子的囊泡中,或者是“不依赖于内涵素的”,其不需要招募内涵素。不依赖于内涵素的内吞的示例性类型包括(例如)巨胞饮。如本文所使用的,术语“内吞激活剂”是指(例如)诱导或激活内吞途径或过程,从而提高内吞途径的试剂。示例性的“内吞激活剂”提高了线粒体从胞外环境的吸收。
如本文所使用的,术语“巨胞饮”是指介导溶质分子、营养物和抗原的非选择性吸收的不依赖于内涵素的内吞形式。
如本文所使用的,术语“化合物”是指能够引起所期望的生物学功能的化合物。所述术语包括(但不限于)DNA、RNA、蛋白、多肽和其它化合物,包括生长因子、细胞因子、激素或小分子。
如本文所使用的,术语“肽”、“多肽”和“蛋白”是可互换使用的并且以其最广泛的含义表示受约束(即,具有一些结构元件,如(例如)引起β转角或β折叠的氨基酸的存在,或者例如,通过二硫键合的Cys残基的存在所造成的环化)或者不受约束(例如,直链或非结构化)氨基酸序列。组成多肽的氨基酸可以是天然来源的或者可以是合成的。可以从生物样品纯化多肽。多肽、蛋白或肽还涵盖了修饰的多肽、蛋白或肽,例如,糖多肽、糖蛋白或糖肽;或者脂多肽、脂蛋白或脂肽。
如本文所使用的,术语“调节”和“调节剂”旨在表示基础内稳态状态的性质或组分改变。示例性调节包括通过破坏内稳态改变细胞代谢,从而使细胞代谢显著降低。术语“调节剂”包括抑制剂和激活剂。抑制剂是(例如)抑制所期望的蛋白、途径或过程的表达或修饰,或者结合至、部分或完全阻断刺激,降低、防止、延迟激活,使所述靶标蛋白、途径或过程的活性失活、脱敏或下调的试剂。在某些实施方式中,抑制剂是靶标蛋白、途径或过程的拮抗剂。激活剂是(例如)诱导或激活所述靶标蛋白、途径或过程的表达或修饰,或者结合至、刺激、提高、打开、激活、有利于、增强抑制剂活性的激活、使所述的靶标蛋白(或者编码多核苷酸)、途径或过程的活性敏化或上调的试剂。在某些实施方式中,激活剂是靶标蛋白、途径或过程的激动剂。调节剂包括天然存在的和合成的配体、拮抗剂和激动剂(例如,用作激动剂或拮抗剂的小化学分子、抗体等)。还将理解调节剂可以是生物(例如,抗体)或化学的。
如本文所使用的,术语“之前”旨在表示在事件开始前的一段时间,从而它是足够长的时间以实现和保持所期望的结果(例如,抗生素选择)或者效应(例如,生物效应),同时在预期事件起始前,所期望的结果或效应不会完全消散。例如,在示例性情况中,应理解在外源线粒体和/或外源mtDNA的转移之前,调节细胞代谢将包括足够的一段时间以(例如)显示出所期望的生物效应(例如,S6激酶磷酸化作用的升高),同时在发生外源线粒体和/或外源mtDNA的转移之前,所述生物效应不会恢复到内稳态状态。
如本文所使用的,术语“营养胁迫”是指足以在细胞内稳态中生产扰动的养分缺乏或营养饥饿条件,如引起自噬、AMPK信号转导和/或mTOR信号转导通路。示例性的营养胁迫条件包括血清饥饿、必需氨基酸去除和/或代谢途径破坏。
术语“核酸”和“多核苷酸”在本文中可互换地用于描述由核苷酸,例如,脱氧核糖核苷酸或核糖核苷酸,或者合成产生的化合物所组成的任何长度的聚合物,所述化合物可以以类似于两种天然存在的核酸的序列特异性方式与天然存在的核酸杂交,例如,可以参与沃森-克里克碱基配对相互作用。如本文所使用的,在多核苷酸序列的背景中,术语“碱基”与“核苷酸”是同义的,即多核苷酸的单体亚基。当用于表示核苷酸时,缩写“A”旨在表示腺嘌呤(A)。当用于表示核苷酸时,缩写“G”旨在表示鸟嘌呤(G)。当用于表示核苷酸时,缩写“C”旨在表示胞嘧啶(C)。当用于表示核苷酸时,缩写“T”旨在表示胸腺嘧啶(T)。
当用于表示载体时,术语“药物可用的”旨在表示必须与所述制剂的其它成分相容并且对其受体无害的载体、稀释剂或赋形剂。
除非另外说明,否则本文所提供的实施方式的实践将使用常规分子生物学、微生物学和免疫学方法,其在本领域工作人员的技术范围内。这些技术在文献中有充分说明。特别适合参考的教科书的实例包括以下:Sambrook等人,Molecular Cloning:A LaboratoryManual,第3版,Cold Spring Harbor Laboratory,New York(2001);Ausubel等人,CurrentProtocols in Molecular Biology,John Wiley and Sons,Baltimore,MD(1999);Glover主编,DNA Cloning,第I和II卷(1985);Gait主编,Oligonucleotide Synthesis(1984);Hames&Higgins主编,Nucleic Acid Hybridization(1984);Hames&Higgins主编,Transcription and Translation(1984);Freshney主编,Animal Cell Culture:Immobilized Cells and Enzymes(IRL Press,1986);等人,Plant MolecularBiology–A Laboratory Manual(Melody S.Clark主编;Springer-Verlag,1997);Immunochemical Methods in Cell and Molecular Biology(Academic Press,London);Scopes,Protein Purification:Principles and Practice(Springer Verlag,N.Y.,第2版.1987);和Weir&Blackwell主编,Handbook of Experimental Immunology,第I-IV卷(1986)。
5.2产生线粒体替换的细胞(MirC)的方法
本发明部分基于以下发现:任何降低内源线粒体功能的试剂,包括减少内源线粒体DNA(mtDNA)的试剂可以提高外源线粒体的无创转移。然而,内源mtDNA的完全消除,如ρ(0)细胞防止了这种提高。这是因为外源线粒体的无创转移是能量依赖性的,并且内源mtDNA的完全消除极大限制了可用于辅助无创转移过程的能量。类似地,当线粒体功能和/或mtDNA不受干扰时,例如,当线粒体仅通过离心共培育(即“附加”)或添加时,外源线粒体的无创转移也是低效的。
因此,本文提供了产生线粒体替换的细胞(MirC)的方法,其可以包括(a)将受体细胞与减少内源mtDNA拷贝数的试剂或者降低线粒体功能的试剂接触;(b)将所述受体细胞与所述试剂培育足够的一段时间以分别部分减少内源mtDNA拷贝数或者部分降低所述受体细胞中的内源线粒体功能;和(c)将(1)其中内源mtDNA或内源线粒体功能已分别部分降低的来自步骤(b)的受体细胞和(2)来自健康供体的外源线粒体共培育足够的一段时间以将外源线粒体无创转移至所述受体细胞,借此产生线粒体替换的细胞。本文还提供了产生线粒体替换的细胞的方法,其包括实施如上所述的步骤(a)和(b),然后(c)将(1)其中内源mtDNA或内源线粒体功能已分别部分降低的来自步骤(b)的受体细胞和(2)来自健康供体的外源mtDNA共培育足够的一段时间以将外源mtDNA无创转移至所述受体细胞,借此产生线粒体替换的细胞。在某些实施方式中,通过外源线粒体转移外源mtDNA。
MirC的产生可以是多种应用的有用策略。举例来说,外源线粒体、外源mtDNA或它们的组合向受体细胞的转移可以用于(例如)替换功能障碍的内源线粒体和/或由具有功能性线粒体的突变mtDNA组成的内源线粒体,如由野生型mtDNA组成的线粒体。在某些实施方式中,在具有编码功能障碍的线粒体的内源mtDNA的受体细胞中实施本文所提供的方法。在具体的实施方式中,所述内源mtDNA是突变mtDNA。在某些实施方式中,所述内源mtDNA是异质的并且由野生型mtDNA和突变mtDNA两者组成。
如上所述,在某些应用中,外源线粒体、外源mtDNA或它们的组合的转移可以包括功能性线粒体或野生型mtDNA的转移以替换(例如)功能障碍或由突变mtDNA组成的内源线粒体。因此,在某些实施方式中,所述外源mtDNA是野生型mtDNA。在其它实施方式中,受体细胞的内源线粒体具有野生型mtDNA和功能障碍的内源线粒体。例如,具有野生型mtDNA的受体细胞的示例性功能障碍的线粒体可以包括编码线粒体蛋白的突变核DNA或者由于继发效应,如衰老或疾病所引起的功能障碍的线粒体。
因此,可以使用本文所述的方法替换功能障碍的内源线粒体、由突变mtDNA组成的内源线粒体或它们的组合。可以由于多种因素发生线粒体功能障碍。非限制性实例包括由于疾病(例如,年龄相关疾病、线粒体疾病或病症、神经退行性疾病、视网膜疾病、遗传疾病)、糖尿病、听觉障碍或它们的任意组合所造成的线粒体功能障碍。线粒体功能障碍可以包括内源线粒体功能降低了大于5%,大于10%,大于20%,大于30%,大于40%,大于50%,大于60%,大于70%,大于80%或者大于90%。因此,在一些实施方式中,内源线粒体包括功能降低了约5%,约10%,约15%,约20%,约25%,约30%,约40%,约50%,约60%,约70%,约80%,约90%或约100%的线粒体。
本文所提供的方法适用于同质和异质mtDNA两者。在具体实施方式中,所述内源mtDNA是单一类型的mtDNA(即内源mtDNA是均质的)。在其它具体的实施方式中,内源mtDNA包括不止一种类型的mtDNA(即内源mtDNA是异质的)。在一些实施方式中,异质mtDNA包括野生型mtDNA和突变mtDNA两者。通常,突变mtDNA的比例决定了表型的严重程度并且可以影响线粒体功能降低的程度。例如,在一些实施方式中,异质mtDNA是5%的突变mtDNA和95%的野生型mtDNA,并且线粒体功能降低5%。在其它实施方式中,异质mtDNA是55%的突变mtDNA和45%的野生型mtDNA,并且线粒体功能降低55%。然而,应理解突变mtDNA的百分比不需要与线粒体功能成正比。
功能障碍的线粒体的特征通常在于电子传递链效率降低和高能分子,如腺苷-5'-三磷酸(ATP)的合成减少,有害活性氧(ROS)的漏出和/或细胞呼吸破坏。本领域技术人员将理解如何评价线粒体功能。例如,细胞-基测定,如Seahorse Bioscience XF胞外通量分析仪(Extracellular Flux Analyzer)可以在单次试验中用于实施基础氧消耗、糖酵解速率、ATP产生和呼吸量的测定以评价线粒体功能障碍。类似地,Oroboros 02K呼吸仪也可以用于建立定量功能性线粒体诊断。应理解如上所述的测定实例是示例性的并且不包括评价线粒体功能的所有方法。
在一些实施方式中,功能性线粒体具有完整外膜。在一些实施方式中,功能性线粒体是完整线粒体。在另一个实施方式中,功能性线粒体随时间以提高的速率消耗氧气。在另一个实施方式中,通过氧消耗测量线粒体的功能性。在另一个实施方式中,可以通过本领域中已知的任何方法测量线粒体的氧消耗,如(但不限于)MitoXpress荧光探针(Luxcel)。在一些实施方式中,功能性线粒体是在存在ADP和底物,如(但不限于)谷氨酸盐、苹果酸盐或琥珀酸盐的情况下显示出氧消耗速率升高的线粒体。每种可能性代表了本发明的单独的实施方式。在另一个实施方式中,功能性线粒体是产生ATP的线粒体。
尽管本文所提供的方法可以用于从具有功能障碍的线粒体、突变mtDNA或它们的组合的受体细胞产生MirC,但是还应理解MirC的产生不需要在具有功能障碍的线粒体的受体细胞中进行。在一些实施方式中,使用具有功能性内源线粒体、野生型mtDNA或它们的组合的受体细胞产生MirC,并且外源线粒体也是功能性的,含有野生型mtDNA或它们的组合。例如,可以使用本文所提供的方法减少内源野生型mtDNA,并且可以将外源野生型mtDNA转移至受体细胞中,如使用来自健康供体细胞(例如,具有相对低PDL的年轻细胞)的外源mtDNA在“老”受体细胞(例如,来自衰老对象的细胞或者具有相对高群体倍增水平(PDL)的细胞)中的线粒体替换。因此,在某些实施方式中,外源mtDNA来自作为健康供体细胞的供体细胞,例如,比受体细胞年轻的供体细胞。在某些实施方式中,供体和受体细胞的PDL差异为约1.5倍,约2倍,约2.5倍,约3倍,约4倍,约5倍或者大于5倍。在其它实施方式中,供体和受体细胞来自年龄相差约1.5倍,约2倍,约2.5倍,约3倍,约4倍,约5倍或者大于5倍的对象。然而,应理解供体细胞和受体细胞之间的年龄差异不是所要求的。在一些实施方式中,供体和受体细胞是相同年龄的,并且供体细胞是健康的细胞。
在其它实施方式中,在具有功能性内源线粒体,如野生型内源mtDNA的受体细胞中进行MirC的产生,并且外源mtDNA是突变的,编码功能障碍的线粒体,外源线粒体是功能障碍的或它们的组合。在其它实施方式中,外源线粒体、外源mtDNA或它们的组合来自比受体细胞老的供体细胞。例如,在一些实施方式中,可以通过用来自突变和/或编码功能障碍的线粒体的供体细胞的外源mtDNA替换受体细胞中的功能性线粒体来产生线粒体疾病或病症模型。应理解本文所述的实例是示例性的并且不包括涉及mtDNA替换的所有组合。
如本文所提供的,可以使用减少内源mtDNA的试剂或者降低内源线粒体功能的试剂实践产生MirC的方法。在某些情况中,可以使用两种试剂的组合。能够降低线粒体功能的试剂在本领域中是熟知的,并且在本领域技术人员的技术范围内。示例性的试剂包括在存在ADP或解偶联剂的情况下阻断呼吸的线粒体呼吸链抑制剂,如复合物III抑制剂(例如,粘噻唑)、复合物IV抑制剂(例如,叠氮化钠、氰化钾(KCN))或者复合物V抑制剂(例如,寡霉素);在添加ADP后消除氧消耗爆发,但是对解偶联剂-刺激的呼吸无影响的磷酸化抑制剂;消除呼吸链和据观察具有完整线粒体的磷酸化系统之间的必须连接的解偶联剂(例如,二硝基苯酚、CCCP、FCCP);防止ATP输出或原材料跨过线粒体内膜输入的ATP/ADP转运抑制剂,如腺嘌呤核苷酸转位酶抑制剂(例如,苍术苷);使内膜对通常不能跨膜的化合物可透过的离子载体(例如,缬氨霉素、尼日利亚菌素);或者阻断一个或多个TCA循环酶或辅助反应的三羧酸循环抑制剂(例如,亚砷酸盐、氨基氧乙酸盐)。应理解如上所述能够降低线粒体功能的试剂是非限制性的,并且本领域技术人员可以使用本领域中已知的技术容易地识别能够降低线粒体功能的适合的试剂。
在具体的实施方式中,降低内源线粒体功能的试剂短暂降低内源线粒体功能。在其它实施方式中,降低内源线粒体功能的试剂永久降低内源线粒体功能。在优选的实施方式中,降低内源线粒体功能的试剂部分降低内源线粒体功能。
多种试剂可以用于减少mtDNA。在某些实施方式中,减少mtDNA的试剂选自编码包含线粒体-靶向序列(MTS)和核酸内切酶、核酸内切酶或小分子的融合蛋白的核酸。在某些实施方式中,所述小分子是核苷反转录酶抑制剂(NRTI)。所述核酸可以是信使核糖核酸(mRNA)或者脱氧核糖核酸(DNA)。在某些实施方式中,减少mtDNA的试剂是编码核酸内切酶的质粒DNA表达载体盒。在优选的实施方式中,所述试剂是编码具有MTS的核酸内切酶的质粒DNA表达载体盒。可以使用多种表达载体盒,并且本领域技术人员将理解基于宿主细胞,使核酸内切酶能够成功表达所需的必要考虑。例如,哺乳动物表达载体,如具有巨细胞病毒(CMV)启动子、SV40启动子或CAG启动子的载体将适合于核酸内切酶在哺乳动物细胞,而不是非哺乳动物细胞中的表达。类似地,应理解还可以使用病毒表达载体并且本领域技术人员将理解这些病毒表达载体可能需要辅助质粒(即包膜和包装质粒)与转移质粒串联使用。在其它实施方式中,所述试剂是编码核酸内切酶的mRNA。在其它优选实施方式中,所述试剂是编码具有MTS的核酸内切酶的mRNA。在其它实施方式中,所述试剂是作为重组蛋白的核酸内切酶。在其它实施方式中,所述试剂是小分子,如(例如)破坏mtDNA合成的小分子。用于产生任何表达方法的技术是本领域技术人员已知的并且可以容易地实施而无需过度实验。在优选的实施方式中,所述试剂适合于临床使用。
在具体的实施方式中,所述核酸内切酶可以是将DNA双螺旋在特定位点切割成片段的限制性内切酶,如XbaI,其切割以下DNA序列:
所述核酸内切酶还可以包括(例如)除XbaI以外的限制性内切酶,如EcoRI、BamHI、HindIII或PstI,它们均在多个位点消解mtDNA。核酸内切酶具有限定的识别位点,其允许预测它们对mtDNA的灵敏度。限制性内切酶的限定识别位点,如(例如)XbaI、EcoRI和SmaI对给定核酸序列特异。因此,在一些实施方式中,可以使用已合并成DNA核酸酶的锌指和转录激活子样效应因子(TALE)进行内源mtDNA的减小。可以将这两类DNA-结合蛋白工程设计,从而对所关心的新DNA序列具有特异性。类似地,还可以通过添加相应编码基因将成簇规律性间隔短回文重复(CRISPR)/Cas9蛋白引入细胞。因此,在一些实施方式中,所述核酸内切酶可以是可编程核酸酶,如RNA-导向的DNA核酸内切酶(例如,Cas9)、锌指核酸酶(ZFN)或者转录激活子样效应因子核酸酶(TALEN)。应理解如上所述的核酸酶是非限制性的,并且本领域技术人员可以使用本领域中已知的技术容易地识别适合的核酸内切酶。例如,剑桥参考序列或类似的共有序列可以通过(例如)计算机分析用于鉴别识别mtDNA序列的适合的核酸内切酶。在具体的实施方式中,核酸内切酶切割野生型mtDNA序列。在其它实施方式中,核酸内切酶切割突变mtDNA序列。还将理解减少内源mtDNA的试剂不需要是核酸内切酶并且可以使用能够减少mtDNA的任何试剂,包括抑制mtDNA生物合成的试剂,如溴化乙锭。在本文中还考虑了试剂,如(例如)尿石素A或小分子p62-介导的线粒体自噬诱导剂(PMI),其诱导自噬以促进内源线粒体的选择性降解(即线粒体自噬激动剂)。还可以使用核苷反转录酶抑制剂(NRTI)作为减少mtDNA的试剂来实践本发明。
另外,在一些实施方式中,表达载体盒可以包括一种或多种抗生素抗性基因以使得能够选择表达所述表达载体盒的细胞群体。例如,在一些实施方式中,所述表达载体可以包括来自链霉菌属的嘌罗霉素N-乙酰基-转移酶基因(pac),并且可以使用嘌罗霉素选择细胞。在其中使用抗生素,例如,嘌罗霉素进行选择的情况下,所述选择可以是短暂的(例如,24-48小时)以限制对药物的长期暴露。然而,应理解以上所提供的实例仅是示例性的并且所述表达载体盒可以包括其它抗生素抗性基因,如(例如)用于通过杀稻瘟素进行选择的bsr、bls或BSD基因,或者通过潮霉素B进行选择的hph基因。通常将理解用于选择的抗生素的浓度将基于抗生素的类型和细胞类型,并且对于本领域技术人员是无需过度实验而易于可获得的。还将理解可以通过本领域中已知的任何方式产生选择并且不需要包括抗生素抗性。例如,在一些实施方式中,可以通过(例如)细胞表面标志物的荧光激活细胞分选(FACS)或者通过所述表达所编码的荧光蛋白的表达来进行细胞选择。在其它实施方式中,可以根据细胞表型进行选择。例如,在一些实施方式中,具有异质性的细胞中突变内源mtDNA的成功缺失可以导致可选择的表型反应,如(例如)细胞存活。
因此,在一些实施方式中,在引入含有降解mtDNA的核酸内切酶的表达载体盒之后选择细胞。在一些实施方式中,选择细胞以获得表达降解mtDNA的核酸内切酶的均一细胞群体。在具体的实施方式中,在引入含有降解mtDNA的核酸内切酶的表达载体盒之后选择细胞,并产生均一的稳定细胞系。在其它实施方式中,选择细胞以富集表达降解mtDNA的核酸内切酶的细胞群体。如上所述,通过选择的这种富集可以包括对抗生素的短暂暴露。基于选择压力的程度和/或方式,富集的细胞可以稳定表达所述核酸内切酶或者短暂表达所述核酸内切酶。应理解富集的群体不需要是均一的,并且表达降解mtDNA的核酸内切酶的该富集的细胞群体相对于未选择的细胞群体,含有更高比例的具有所述核酸内切酶的细胞,但是还可以含有不表达所述核酸内切酶的一些细胞。
在其它实施方式中,在引入含有降解mtDNA的核酸内切酶的表达载体之后不选择细胞。在具体的实施方式中,在引入含有降解mtDNA的核酸内切酶的表达载体之后不选择细胞并且核酸内切酶短暂表达。
用于引入质粒DNA表达载体盒、mRNA和/或重组蛋白的多种方法在本领域中是已知的。在一些实施方式中,通过电穿孔引入质粒DNA表达载体盒。在具体的实施方式中,电穿孔法是流式电穿孔,如MaxCyte流式电穿孔。在其它具体的实施方式中,电穿孔法包括核转染技术,如Lonza的NucleofectorTM技术。在其它实施方式中,通过阳离子脂质转染引入质粒DNA表达载体盒。在其它实施方式中,通过病毒转导引入质粒DNA表达载体盒。应理解如上所述用于引入表达载体盒的方法是非限制性的并且仅旨在是示例性方法,并且本领域中已知的任何方法可以用于引入DNA表达载体盒。
当用于减少内源线粒体的试剂包含核酸内切酶时,核酸内切酶的表达也可以包括引入编码核酸内切酶的mRNA或者作为重组蛋白引入核酸内切酶。在某些实施方式中,MaxCyte电转化仪可以用于mRNA转染,特别是在临床环境中,其已通过了优良制造规范和优良临床规范的标准。可以根据生产商的规程,使用MaxCyte电转化仪进行转染。还将理解如上所述的方法仅是示例性的并且可以使用引入mRNA和/或重组蛋白的任何方式。
可以通过邻近于核酸内切酶编码序列引入线粒体靶向序列(MTS)来实施核酸内切酶对线粒体的特异性靶向,这将导致产生靶向线粒体的融合蛋白。已鉴别了强MTS并且当在它们的N-末端融合时,其显示能够将蛋白质靶向特异性区室,并且将其称为线粒体靶向序列。适合于本发明所述的方法的MTS对于本领域技术人员是熟知的(参见,例如,美国专利No.8,039,587B2,该专利以其全部内容作为参考并入本文)。例如,可以使用针对线粒体基质的MTS,如来自细胞色素c氧化酶亚基IV(COX 4)、亚基VIII(COX 8)或者亚基X(COX 10)的靶向肽的MTS。原则上,能够使融合蛋白成为线粒体运输的蛋白的来源于任何核编码的线粒体基质或内膜酶的任何靶标序列或者人工序列(疏水矩大于5.5,至少两个碱性残基,两亲性α-螺旋构象;参见,例如,Bedwell等人,Mol Cell Biol.9(3)(1989),1014-1025)对于本发明的目的是有用的。
在某些实施方式中,所述MTS是人MTS。在另一个实施方式中,所述MTS来自另一个物种。这些序列的非限制性实例是细胞色素c氧化酶亚基X(COX 10)MTS(MAASPHTLSSRLLTGCVGGSVWYLERRT,SEQ ID NO:36)和细胞色素c氧化酶亚基VIII(COX 8)MTS(MSVLTPLLLRSLTGSARRLMVPRA,SEQ ID NO:37)。MTS序列的其它非限制性实例是通过核DNA编码、在细胞质中翻译(产生)并转运到线粒体中的每个单个线粒体蛋白的天然MTS以及柠檬酸合酶(cs)、硫辛酰胺脱氢酶(LAD)和C6ORF66(ORF)。在它们当中,多种MTS对于每种线粒体酶可以是可交换的。因此,在一些实施方式中,MTS靶向线粒体基质蛋白。在具体的实施方式中,所述线粒体基质蛋白是人细胞色素C氧化酶的亚基VIII。每种可能性代表了用于本发明使用的融合蛋白的单独的实施方式。
一旦将受体细胞与减少内源mtDNA拷贝数的试剂或者降低内源线粒体功能的试剂接触,则将所述受体细胞与所述试剂培育足够的一段时间以分别部分减少所述受体细胞中的内源mtDNA拷贝数或者部分降低所述受体细胞中的内源线粒体功能。识别“足够的一段时间”以允许所述试剂部分减少内源mtDNA拷贝数或者部分降低内源线粒体功能在本领域技术人员的技术范围内。所述足够或适当的时间段将根据多种因素而改变,其包括(但不限于)特定类型的细胞、起始材料的量(例如,受体细胞数目和/或要减少的mtDNA的量)、试剂的量和类型、质粒启动子调节剂和/或培养条件。在多个实施方式中,允许受体细胞中内源mtDNA拷贝数部分减少的足够的一段时间为约1天、约2天、约3天、约4天、约5天、约6天、约7天、约8天、约9天、约10天、约1-2周、约2-3周或约3-4周。在优选的实施方式中,所述足够的一段时间将足够长,从而所产生的受体细胞具有大部分内源mtDNA拷贝数的减少或者大部分内源线粒体的功能的降低并且在将所述受体细胞与外源mtDNA和/或外源线粒体培育之前还基本不含减少内源mtDNA的试剂或者降低内源线粒体功能的试剂。
本发明的重要且新颖的方面在于以下发现:在内源线粒体完全消除的细胞(即(ρ)0细胞)中线粒体转移效率严重降低,但是当内源mtDNA拷贝数减少但未完全消除(即(ρ)-细胞)时,可以得到极大改善。此外,本发明还证实简单的附加或离心规程是无效的,其不会部分减小内源mtDNA拷贝数。因此,在优选的实施方式中,所述受体细胞中内源mtDNA拷贝数的减小是小于内源mtDNA的100%消除。在一些实施方式中,所述受体细胞中的内源mtDNA拷贝数减少了约5%至约99%。在具体的实施方式中,所述减少内源mtDNA拷贝数的试剂将内源mtDNA拷贝数减少了约30%至约70%。在其它实施方式中,所述减少内源mtDNA拷贝数的试剂将所述内源mtDNA拷贝数减小了约50%或以上,约60%或以上,约70%或以上,约80%或以上,或者约90%或以上,或者约95%或以上。在其它实施方式中,减少内源mtDNA拷贝数的试剂将内源mtDNA拷贝数减少了约60%至约90%。还将理解在一些实施方式中,所述减少内源mtDNA拷贝数的试剂减少了线粒体物质。
在某些实施方式中,所述外源mtDNA包含在来自供体细胞的分离的外源线粒体中。可以通过任何一些熟知的技术来实现线粒体的分离,其包括(但不限于)本文所述的和所引用的参考文献中的那些。在某些实施方式中,使用商品化试剂盒,如(例如)Qproteum线粒体分离试剂盒(Qiagen,USA)、MITOISO2线粒体分离试剂盒(Sigma,USA)或者用于培养细胞的线粒体分离试剂盒(Thermo Scientific)分离用于在线粒体转移中使用的外源线粒体。在其它实施方式中,手动分离用于在线粒体转移中使用的外源线粒体。例如,线粒体的示例性手动分离包括通过使供体细胞成粒,清洗来源于在培养中生长的约109个细胞的1-2mL的细胞颗粒,使细胞在低渗缓冲液中膨胀,使用紧密配合的研棒用Dounce或Potter-Elvehjem匀浆器使细胞破裂并通过差速离心分离线粒体,从供体细胞分离线粒体。手动分离也可以包括(例如)蔗糖密度梯度超速离心或自由流动电泳。不希望受任何具体方法的束缚,应理解本文所述的试剂盒和手动方法是示例性的并且可以使用任何线粒体分离方法,并且它将在本领域技术人员的技术范围内。
在一些实施方式中,分离的供体线粒体是基本不含其它细胞器的。在其它实施方式中,分离的线粒体可以含有杂质并且对于线粒体富集。例如,在一些实施方式中,分离的线粒体为约90%纯的,约80%纯的,约70%纯的,约60%纯的,约50%纯的或者它们之间的任何整数。通常,应理解一旦线粒体转移,则与分离的供体线粒体一起包含的任何杂质将不会影响受体细胞的存活力或功能。在具体的实施方式中,外源线粒体、外源mtDNA或它们的组合的转移不包括非线粒体细胞器的转移。
可以通过一些熟知的技术容易地确定分离的线粒体的数量和质量,所述技术包括(但不限于)本文所述的和所引用的参考文献中的那些。例如,在一些实施方式中,通过总蛋白含量的评价确定分离的线粒体的量。多种方法对于总蛋白含量的测量是可用的,如双缩脲和Lowry程序(参见,例如,Hartwig等人,Proteomics,2009Jun;9(11):3209-14)。在其它实施方式中,通过mtDNA拷贝数确定分离的线粒体的量。
在一些实施方式中,分离的线粒体是功能性线粒体。在其它实施方式中,分离的线粒体是功能障碍的线粒体。在一些实施方式中,可以在分离之前评价供体细胞中的线粒体功能。在其它实施方式中,可以从分离的线粒体测定线粒体功能。
线粒体膜完整性的维持是线粒体分离期间的另一重要因素。在一些实施方式中,在本文所提供的方法中使用的mtDNA来自完整的线粒体。在具体的实施方式中,约10%,约20%,约30%,约40%,约50%,约60%,约70%,约80%,约90%或大于90%的分离的线粒体是完整的。可以通过任何一些熟知的技术来实现线粒体膜的完整性,其包括(但不限于)本文所述的和所引用的参考文献中的那些。例如,TMRM、Rhod123、JC-1和DiOC6是用于测量线粒体膜电位的典型探针(参见,例如,Perry等人,Biotechniques,2011Feb;50(2):98-115)。JC-1是广泛使用的用于测量分离的线粒体的内膜电位的染料,并且其基于线粒体内膜的电化学质子梯度。
在本文所提供的方法的某些实施方式中,将具有内源mtDNA部分减小的受体与来自健康供体的外源线粒体共培育足够的一段时间以将外源线粒体无创转移至所述受体细胞,借此产生线粒体替换的细胞。在其它实施方式中,将具有内源mtDNA部分减小的受体与来自健康供体的外源mtDNA共培育足够的一段时间以将外源线粒体无创转移至所述受体细胞,借此产生线粒体替换的细胞。识别“足够的一段时间”以将外源线粒体和/或外源mtDNA无创转移至受体细胞在本领域技术人员的技术范围内。足够或适当的时间段将根据多种因素而改变,其包括(但不限于)特定类型的细胞、起始材料的量(例如,受体细胞数目和/或要替换的内源mtDNA的量)、供体材料的量(例如,外源mtDNA的数量、质量和/或纯度)和/或培养条件。在多个实施方式中,将外源线粒体和/或外源mtDNA无创转移至受体细胞的足够的一段时间为约1天、约2天、约3天、约4天、约5天、约6天、约7天、约8天、约9天、约10天、约1-2周、约2-3周或约3-4周。在某些实施方式中,在共培育期结束时,受体细胞将具有大部分外源mtDNA并且基本不含任何外源线粒体细胞器。
本发明的另一特征在于以下发现:相对于原始受体细胞,MirC中的总mtDNA拷贝数基本不升高。相反,已尝试了其它不太有效的方法来附加线粒体而无需在共培育步骤之前调节受体细胞,或者使用离心转移外源线粒体而无需在离心前调节受体细胞。因此,使用无效方法所得到的细胞群体往往具有总mtDNA拷贝数的大量升高。因此,在某些实施方式中,相对于与减少内源mtDNA拷贝数的试剂接触前的受体细胞的总mtDNA拷贝数,所述线粒体替换的细胞具有不大于约1.1倍,约1.2倍,约1.3倍,约1.4倍,约1.5倍或以上的总mtDNA拷贝数。
无创转移的使用是本发明的另一独特方面。上述方法使用创伤性仪器来注入外源线粒体,通过离心物理迫使线粒体进入细胞或者使用了对受体细胞有害的类似苛刻条件。在临床背景中,特别是当所述受体细胞数可能有限时,如使用造血干细胞或T细胞,苛刻的细胞操作是所不期望的。因此,无创转移的使用是本发明的有益特征,其有助于在临床背景中的使用。
如本文所提供的,外源线粒体、外源mtDNA或它们的组合可以对受体细胞是自体同源的或者同种异体的。在一些实施方式中,相对于受体细胞,外源mtDNA是同种异体的。例如,外源mtDNA可以得自与受体细胞相同的物种,并且具有不同于受体细胞的基因型。在其它实施方式中,外源线粒体、外源mtDNA或它们的组合是自体同源的。举例来说,示例性的自体同源的外源mtDNA可以包括来自健康供体细胞,例如,“年轻”供体细胞,如来自脐带血的“年轻”供体细胞的mtDNA,并且所述受体细胞可以来自相同对象并且可以是“老”受体细胞,其中术语“年轻”和“老”表示群体中细胞的总倍增次数或者细胞所来源的对象的年龄。另一种示例性自体同源的外源mtDNA可以包括(例如)分离自与受体细胞相同的对象的供体mtDNA并在用受体细胞替换它之前进行修饰。在某些实施方式中,仅mtDNA和/或线粒体是同种异体的并且受体细胞对需要外源mtDNA和/或外源线粒体的对象是自生的(autogenic)。
在某些实施方式中,可以通过mtDNA的高变区(HVR)DNA序列,例如,D-环的HV1和/或HV2的测序并将其与供体线粒体和受体细胞两者的序列相比较来评价受体细胞中mtDNA的替换。在具体的实施方式中,可以通过单核苷酸多态性测定识别受体细胞和供体线粒体之间的序列差异。例如,可以将来自受体细胞和供体线粒体的mtDNA的扩增序列克隆至质粒以用作定量标准。
在一些实施方式中,所述细胞(即供体细胞和受体细胞)是动物细胞或植物细胞。在具体的实施方式中,所述细胞是哺乳动物细胞。在一些实施方式中,从哺乳动物对象分离细胞,所述哺乳动物对象选自:人、马、狗、猫、小鼠、大鼠、牛和绵羊。在一些实施方式中,所述细胞是人细胞。在一些实施方式中,所述细胞是培养中的细胞。所述细胞可以直接得自哺乳动物(优选地人)或者得自商品化来源,或者得自组织,或者处于(例如)培养细胞的形式,原地制备或购自商品化细胞来源等。在某些实施方式中,所述细胞是原代细胞(即直接得自活组织,例如,活组织检查材料的细胞)。所述细胞可以来自任何器官,其包括(但不限于)血液或淋巴系统,来自肌肉、任何器官、腺体、皮肤或脑。在某些实施方式中,所述细胞是体细胞。在一些实施方式中,所述细胞选自上皮细胞、神经细胞、表皮细胞、角化细胞、造血细胞(例如,骨髓细胞)、黑素细胞、软骨细胞、肝细胞、B细胞、T细胞、红细胞、巨噬细胞、单核细胞、成纤维细胞、肌细胞、血管平滑肌细胞、肝细胞、脾细胞和胰腺β细胞。
如本文所提供的,在具体的实施方式中,所述供体细胞是处于现代优良制造规范(cGMP)的可商购的细胞培养物。例如,所述供体细胞可以得自细胞库,如WaismanBiomanufacturing,或者类似的商品化资源,如产生符合cGMP的细胞的商品化来源。在一些实施方式中,所述供体细胞是cGMP生产的骨髓来源的间充质基质细胞(BM-MSC)。在其它实施方式中,所述细胞是cGMP级人肝细胞。照此,还将理解供体细胞可以是在分离线粒体之前融化的冷冻细胞。然而,在细胞冷冻之后不需要分离线粒体,并且线粒体可以分离自新鲜细胞并且立即使用,或者在某些实施方式中,可以分离线粒体,然后在转移至受体细胞之前冷冻。
在一些实施方式中,所述细胞是癌细胞。通常,癌细胞分离自癌症,其选自:乳腺癌、前列腺癌、淋巴瘤、皮肤癌、胰腺癌、结肠癌、黑素瘤、恶性黑色素瘤、卵巢癌、脑癌、原发性脑癌、头颈癌、神经胶质瘤、成胶质细胞瘤、肝癌、膀胱癌、非小细胞肺癌、头或颈癌、乳腺癌、卵巢癌、肺癌、小细胞肺癌、韦尔姆斯氏瘤、宫颈癌、睾丸癌、膀胱癌、胰腺癌、胃癌、结肠癌、前列腺癌、泌尿生殖器癌、甲状腺癌、食道癌、骨髓瘤、多发性骨髓瘤、肾上腺癌、肾细胞癌、子宫内膜癌、肾上腺皮质癌、恶性胰岛腺瘤、恶性类癌、绒毛膜癌、阿利贝尔氏病、恶性高钙血症、宫颈增生、白血病、急性淋巴细胞性白血病、慢性淋巴细胞性白血病、慢性粒细胞白血病、急性粒细胞性白血病、急性髓性白血病、慢性粒性白血病、毛细胞白血病、成神经细胞瘤、横纹肌肉瘤、卡波济氏肉瘤、脾大性红细胞增多、原发性血小板增多症、霍奇金氏病、非霍奇金氏淋巴瘤、柔组织肉瘤、骨原性肉瘤、原发性巨球蛋白血病和成视网膜细胞瘤。
在一些实施方式中,所述细胞是干细胞。如本文所使用的,术语“干细胞”是指可以诱导增殖的未分化细胞。干细胞能够自维持或自更新,这表示通过每次细胞分裂,一个子代细胞也将是干细胞。干细胞可以得自胚胎、产后、幼体或成年组织。干细胞可以是多潜能或多能的。如本文所使用的,术语“祖细胞”是指来源于干细胞的未分化细胞并且其本身不是干细胞。一些祖细胞可以产生能够分化成不止一种细胞类型的子代。干细胞包括多潜能干细胞,其可以形成任何身体组织系谱的细胞:中胚层、内胚层和外胚层。因此,例如,干细胞可以选自人胚胎干(ES)细胞;人内细胞团(ICM)/外胚层细胞;人原始外胚层细胞、人原始内胚层细胞;人原始中胚层细胞;和人原始胚(EG)细胞。干细胞还包括多能干细胞,其可以形成构成整个组织的多个细胞谱系,如(但不限于)造血干细胞或神经前体细胞。干细胞还包括全能性干细胞,其可以形成整个生物。在一些实施方式中,所述干细胞是间质干细胞。对于未终末分化的成年细胞,术语“间质干细胞”或“MSC”是可互换使用的,基于来自生物活性因子,如细胞因子的多种影响,其可以分裂以获得干细胞或者不可逆分化以产生间充质细胞系谱细胞,例如,脂肪、骨、软骨、弹性和纤维结缔组织、成肌细胞)以及除起源于胚胎中胚层的那些以外的组织(例如,神经细胞)。在一些实施方式中,所述干细胞是部分分化的或分化细胞。在一些实施方式中,所述干细胞是诱导的多潜能干细胞(iPSC),其已重编程或去分化。在具体的实施方式中,所述受体细胞是iPSC。在其它实施方式中,所述受体细胞是造血干细胞(HSC)或MSC。干细胞可以得自胚胎、胎儿或成年组织。
在其它实施方式中,所述细胞是免疫细胞。在具体的实施方式中,所述受体细胞是免疫细胞。在一些实施方式中,所述免疫细胞选自T细胞、吞噬细胞、小胶质细胞和巨噬细胞。在具体的实施方式中,所述T细胞是CD4+T细胞。在其它实施方式中,所述T细胞是CD8+T细胞。在其它实施方式中,所述T细胞是嵌合抗原受体(CAR)T细胞。在具体的实施方式中,所述受体细胞是处于T细胞功能障碍状态或接近T细胞功能障碍状态的耗竭或近耗竭的T细胞。
5.3提高线粒体转移的方法
本文还提供了用于mtDNA和/或线粒体转移的方法,其包括第二活性剂结合5.2节中所述的任何方法的使用。已报道线粒体转移包括内吞途径,它是ATP-依赖性过程。例如,在某些细胞培养条件下,已观察到线粒体通过巨胞饮被吞没(参见,例如,Kitani等人,JCell Mol Med.,2014,18(8):1694-1703)。因此,本发明还涉及以下新的发现:在受体细胞与外源线粒体和/或外源mtDNA共培育之前,第二活性剂的使用可以促进外源线粒体和/或外源mtDNA的吸收。
多种类型的试剂可以用于促进外源线粒体和/或外源mtDNA的吸收。在一些实施方式中,所述第二活性剂选自大分子、小分子或细胞疗法,并且所述第二活性剂任选地选自雷帕霉素、NR(烟酰胺核糖)、苯扎贝特、艾地苯醌、重酒石酸巯基乙胺(RP103)、艾拉米肽(elamipretide)(MTP131)、奥玛韦隆(omaveloxolone)(RTA408)、KH176、凡替醌酮(Vatiquinone)(Epi743)、硫辛酸、A0001(α-生育醌)、线粒体CoQ10(MitoQ)、SkQ1(Visomitin)、白藜芦醇、姜黄素、生酮治疗、缺氧和内吞激活剂。在具体的实施方式中,所述内吞激活剂是细胞代谢的调节剂。可以使用本领域技术人员已知的多种方法调节细胞代谢。在某些实施方式中,细胞代谢的调节包括营养饥饿、化学抑制剂或小分子。
如上所述,已报道通过内吞途径发生完整线粒体的转移。例如,可以通过经由内吞途径的完整线粒体的吸收来转移所述外源线粒体和/或外源mtDNA。内吞途径可以再分成4类:1)内涵素-介导的内吞,2)细胞膜穴样内陷,3)巨胞饮和4)吞噬。通过小(直径约100nm)囊泡介导内涵素-介导的内吞,所述囊泡具有由主要与细胞溶质蛋白内涵素有关的蛋白复合物组成的形貌特征性外壳(morphologically characteristic coat)。因此,在某些实施方式中,用于线粒体转移的内吞途径是内涵素-依赖性内吞途径。在其它实施方式中,用于线粒体转移的内吞途径是不依赖于内涵素的途径。在具体的实施方式中,所述内吞途径是巨胞饮。
已表明巨胞饮是营养剥夺环境中的重要过程。因此,假设细胞营养物不足或者通过足够营养激活的途径或靶标分子(如mTOR)的抑制可以是提高完整线粒体向胞液的细胞吞没的策略。具体地,如本文所提供的,据发现mTOR的抑制可以提高外源线粒体的吸收。mTOR是氨基酸、能量、氧和生长因子的必要传感器,并且是参与胞外营养物吸收的蛋白、脂质和核苷酸合成的关键调节因子。因此,在一些实施方式中,本文所提供的方法还包括将受体细胞与可以提高巨胞饮的小化合物、肽或蛋白接触。在具体的实施方式中,本文所提供的方法还包括在外源线粒体和/或外源mtDNA转移之前,调节受体细胞的细胞代谢。在某些实施方式中,使用可以提高巨胞饮的相同小化合物、肽或蛋白进行细胞代谢的调节。
可以通过任何一些熟知的技术来实现细胞代谢的调节,其包括(但不限于)本文所述的和所引用的参考文献中的那些。例如,在一些实施方式中,通过营养饥饿或营养剥夺进行细胞代谢的调节。在其它实施方式中,通过化学抑制剂或小分子进行细胞代谢的调节。在具体的实施方式中,所述化学抑制剂或所述小分子是mTOR抑制剂。
已知多种化合物抑制mTOR,包括雷帕霉素,也称为西罗莫司(CAS号53123-88-9;C51H79NO13)和雷帕霉素衍生物(例如,雷帕霉素类似物,也称为“rapalogs”)。雷帕霉素衍生物包括(例如)替西罗莫司(CAS号162635-04-3;C56H87NO16)、依维莫司(CAS号159351-69-6;C53H83NO14)和地磷莫司(CAS号572924-54-0;C53H84NO14P)。因此,在一些实施方式中,本文所提供的用于线粒体转移的方法还包括在外源线粒体和/或外源mtDNA转移之前,使用雷帕霉素或其衍生物调节受体细胞的细胞代谢。应理解如上所述用于调节细胞代谢的实施方式是非限制性的,并且调节细胞代谢不需要包括化合物或小分子。
因此,在一些实施方式中,可以作为单独的方法或者与本文所提供的任何方法(如包括受体细胞的内源线粒体的部分减小的方法)组合使用包括临床批准的药物的雷帕霉素或其衍生物以提高外源线粒体的转移效率。
本领域技术人员将理解其它递送方法也可以用于引入外源线粒体和/或外源mtDNA,并且巨胞饮是示例性途径。在一些实施方式中,可以通过内涵素-依赖性内吞或者不依赖于内涵素的内吞递送mtDNA。在具体的实施方式中,所述不依赖于内涵素的途径可以是(例如)CLIC/GEEC内吞途径、Arf6-依赖性内吞、脂阀结构蛋白-依赖性内吞、巨胞饮、环状膜皱褶(circular doral ruffles)、吞噬或者反式-内吞。还将理解可以通过使用刺激线粒体递送的任何化合物,如内吞激活剂来提高外源线粒体和/或外源mtDNA的递送。适合于激活胞吞的非限制性示例性化合物包括(例如)佛波醇-12-豆蔻酸酯-13-乙酸酯(PMA)(C36H56O8)、12-O-十四酰佛波醇13-乙酸酯(TPA)(C36H56O8)、丹参酮IIA磺酸钠(TSN-SS)(C19H17O6S.Na)和佛波醇-12,13-二丁酸酯或其衍生物。此外,还将理解可以使用非内吞介导的mtDNA和/或线粒体转移,包括绕过内吞和/或细胞融合的方法。
5.4治疗方法
本文提供了用于治疗与突变mtDNA和/或功能障碍的线粒体有关的病况的多种方法,组合物用于治疗与突变mtDNA和/或功能障碍的线粒体有关的病况的使用和组合物在生产用于治疗与突变mtDNA和/或功能障碍的线粒体有关的病况的药剂中的使用。还提供了治疗方法,其包括使用外源线粒体和/或外源mtDNA来恢复或提高内源线粒体功能,使用组合物恢复或提高内源线粒体功能和组合物在生产用于治疗需要线粒体替换的对象的药剂中的使用。在某些实施方式中,所述治疗包括线粒体功能障碍的预防。
5.4.1治疗年龄相关疾病的方法
在某些实施方式中,本文提供了治疗患有或怀疑患有年龄相关疾病的对象的方法,其包括5.2节和/或5.3节中所述的任何方法。在一些实施方式中,本文提供了治疗患有或怀疑患有年龄相关疾病的对象的方法,其包括通过以下方法离体或体外产生线粒体替换的细胞:将受体细胞与减少内源mtDNA的试剂或降低内源线粒体功能的试剂接触,将所述受体细胞与所述试剂培育足够的一段时间以部分减少所述受体细胞中的mtDNA拷贝数或者部分降低所述内源线粒体功能,将(1)其中内源mtDNA或内源线粒体功能已部分降低的受体细胞和(2)来自健康供体的外源线粒体和/或外源mtDNA共培育足够的一段时间以将外源线粒体无创转移至所述受体细胞,借此产生线粒体替换的细胞,然后向患有或怀疑患有年龄相关疾病的对象施用治疗有效量的线粒体替换的受体细胞。
在某些实施方式中,所述年龄相关疾病包括自体免疫疾病、代谢疾病、遗传疾病、癌症、神经退行性疾病和免疫衰老。所述代谢疾病可以包括糖尿病。可以通过本文所提供的方法治疗的神经退行性疾病的非限制性实例包括阿尔茨海默氏病或帕金森氏病。另外,能够治疗的遗传疾病包括早年衰老综合症、沃纳综合征和亨廷顿病。还考虑了涉及功能障碍的线粒体的其它年龄相关疾病。
在某些实施方式中,治疗患有或怀疑患有年龄相关疾病的对象的方法包括产生MirC,其中用于产生MirC的受体细胞是T细胞或造血干细胞(HSC)。例如,可以替换衰老T细胞或造血干细胞(HSC)中的内源mtDNA、内源线粒体或它们的组合以用于复壮。体外或离体线粒体替换可以是使用人T细胞和/或造血干细胞治疗患病患者的可行选择。因此,在一些实施方式中,本文所提供的方法可以通过以下方法用于在细胞中延缓衰老和/或延长寿命:将来自健康、非衰老细胞的分离的外源线粒体无创转移至衰老或近衰老细胞中以使受体细胞复壮,并且然后可以将所产生的复壮MirC施用于患有或怀疑患有年龄相关疾病的患者。
如本文所证实的,衰老T细胞的复壮是一种可能的实施方式,通过该实施方式本发明可以用于治疗患有年龄相关疾病,如癌症的对象。举例来说,可以通过使用本文所提供的方法使显示出衰老相关分泌表型(SASP),包括炎性细胞因子、生长因子和蛋白酶、细胞群体倍增速率降低和/或减缓、端粒缩短、DNA损伤应答(DDR)提高或它们的组合的老T细胞复壮,从而无创转移(例如)来自与患有年龄相关疾病,如癌症的对象自体同源的年轻、健康的T细胞的分离的线粒体。然后,可以向所述对象施用具有年轻、非衰老细胞的特征的T细胞-来源的MirC以用于治疗年龄相关疾病。
因此,在具体的实施方式中,治疗患有或怀疑患有年龄相关疾病的对象的方法包括MirC的产生,其中所述受体细胞是T细胞。通过代谢途径调控T细胞命运,其中糖酵解或氧化磷酸化(OXPHOS)负责向T细胞提供大部分能量。选择糖酵解占优势的T细胞来分化成效应因子T细胞,而将OXPHOS占优势的T细胞用于记忆T细胞。因此,外源线粒体和/或mtDNA可以用于调节T细胞命运。例如,就过敏症而言,外源线粒体和/或mtDNA可以用于使超激活T细胞平静。在其它情况下,如在癌症免疫疗法中,外源线粒体和/或mtDNA可以为抗-肿瘤T细胞赋能(empower)以使T细胞持续更长时间或者有利于T细胞溶胞能力和/或降低肿瘤负荷。此外,使用嵌合抗原受体T细胞(CAR T)的新兴治疗使用了自体同源的T细胞。那些CAR T细胞可能由于衰老或营养不良,如在癌症严重病理期中常见的恶病质而处于疲劳。线粒体替换技术可以为CAR T提供能量并使其复壮以提供更多的ATP,从而导致更好的结果。
因此,在某些实施方式中,治疗对象的方法包括作为T细胞的受体细胞。所述T细胞可以是CD4+T细胞,CD8+T细胞或者CAR T细胞。在具体的实施方式中,受体T细胞中的线粒体替换导致产生了具有延长寿命的T细胞。例如,寿命可以提高约1.5倍,约2倍,约3倍,约4倍,约5倍或者大于5倍。在具体的实施方式中,与无线粒体替换的T细胞相比,受体T细胞中的线粒体替换抑制或延缓受体T细胞衰老。如5.2节中所述,可以使用来自比受体细胞年轻的供体细胞的外源线粒体和/或外源mtDNA来实施mtDNA替换,从而延长寿命。在某些实施方式中,供体和受体细胞的PDL差异为约1.5倍,约2倍,约2.5倍,约3倍,约4倍,约5倍或者大于5倍。在其它实施方式中,所述供体和受体细胞来自年龄相差约5年,约10年,约15年,约20年或大于20年的对象。在其它具体的实施方式中,相对于不具有线粒体替换的T细胞,受体T细胞中的线粒体替换导致产生了具有提高的溶胞能力的T细胞。在其它实施方式中,T细胞中的线粒体替换导致肿瘤负荷降低。
尽管在某些实施方式中,质粒-基基因转染可以用于产生具有外源线粒体和/或外源mtDNA的T细胞,但是在其它实施方式中,可以使用mRNA转染。mRNA转染的使用可以降低整合到宿主基因组中的RNA序列的概率,并且还可以具有将引起内源mtDNA减小的最小长期基因表达。
在某些实施方式中,MaxCyte电转化仪可以用于mRNA转染,特别是在临床环境中,其已通过了优良制造规范和优良临床规范的标准。可以根据生产商的规程,使用MaxCyte电转化仪进行转染。
治疗患有或怀疑患有年龄相关疾病的对象的方法还可以包括使用本文所提供的方法的MirC的产生,其中所述受体细胞是造血干细胞(HSC)。造血干细胞(HSC)不仅提供血细胞,而且还提供(例如)通过转分化将受损的固有细胞固定在远端器官的内皮。此外,已报道HSC的机能紊乱参与全身衰老。因此,已考虑HSC-来源的MirC可以在任何年龄相关疾病中用作治疗方法。
另外,同种异体的HSC移植可以导致移植物排斥或甚至移植物抗宿主病。自体同源的HSC移植通常是更安全且更实用的疾病干预措施。例如,自体同源的HSC移植通常不需要通过免疫抑制剂预处理,如辐射和化学试剂。因此,设想了使用本文所提供的方法,在自体同源的HSC中使用来自健康年轻线粒体的外源mtDNA体外或离体产生MirC,然后使其返回患者身体。
在某些实施方式中,HSC对需要线粒体和/或mtDNA替换的对象是自体同源的,并且所述外源mtDNA是同种异体的。如本文所提供的,HSC中的mtDNA替换可以导致产生具有功能性线粒体的分化细胞和/或具有改善的功能的分化细胞。因此,可以在HSC移植的背景中使用本文所提供的方法。
衰老改变生物过程,并且导致发生退行性病症,如阿尔茨海默氏病、动脉粥样硬化、骨质疏松症、2型糖尿病以及造成慢性肾病和慢性阻塞性肺病的组织纤维化。线粒体可以通过由线粒体产生的活性氧在衰老中起作用,其可以影响衰老过程。衰老中的线粒体功能障碍处于与营养感应失调有关的恶性循环,其中由烟酰胺磷酸核糖基转移酶(NAMPT)的下调和聚(ADP-核糖)聚合酶1(PARP1)的超激活所引起的烟酰胺腺嘌呤二核苷酸(NAD+)不足导致了NAD+-依赖性脱乙酰基酶sirtuin 1(SIRT1)的抑制。然后,其转向PGC1α的乙酰化-依赖性失活,因此导致了NAD+可用性放大的线粒体生物发生的降低。PGC1α的低活性不仅导致了核中编码的线粒体蛋白表达的下调,而且还导致与线粒体DNA相邻的线粒体转录因子TFAM的表达下调。
除包括p53和p16/Rb的双核心衰老-调控途径之外,其中释放一系列炎性细胞因子、趋化因子和蛋白酶,如IL-1、IL-6/VEGF、IL-8和CXCL9/MMP的衰老-相关分泌表型(SASP)是衰老中最具特征性的现象之一。通过正常条件下的选择性自噬,通过与自噬接头p62的结合使转录因子GATA4降解,然而DNA损伤应答(DDR)激酶ATM(共济失调毛细血管扩张突变的)和ATR(共济失调毛细血管扩张和Rad3-相关的)接收衰老信号以有利于GATA4和p62之间的解离和稳定GATA4,其反过来通过TRAF3IP2(肿瘤坏死因子受体-相关因子相互作用蛋白2)和IL1A激活NF-kB并支持SASP。在rho0细胞中SASP完全受阻(通过受迫的线粒体自噬建立的mtDNA游离细胞)。在实验性IVF中,来源于老对象的卵母细胞的线粒体替换确保促进了接合子形成、胚胎发育和着床以及怀孕的成功率。
蛋白质稳态(蛋白内稳态)受损是衰老的另一种特征。通过翻译调控、蛋白折叠陪护、泛素-蛋白酶体系统(UPS)和自噬-溶酶体系统严格维持蛋白质稳态的完整性。由于侣伴蛋白基于ATP,因此随衰老而降低的生物能损害了修正蛋白折叠的功能。UPS和自噬-溶酶体系统两者,包括线粒体自噬随时间衰退。这3种系统的交替产生了不在胞液中再循环的聚集体,从而导致了退行性病症。在线粒体基质中,异常蛋白的积累不仅会启动所述系统以使其降解,而且还将为恢复线粒体的核通讯功能(称为线粒体未折叠蛋白反应(UPRmt))提供机会。所有上述途径包括线粒体。体细胞中的线粒体替换可以破坏衰老的有害恶化循环,减缓衰老过程并且甚至使细胞复壮。
因此,本文所提供的方法通过用突变mtDNA,用可以具有自体同源或同种异体来源的年轻和/或健康线粒体替换内源功能障碍的线粒体,如内源线粒体为治疗异质性和/或治疗多种疾病,如与衰老有关的疾病提供了临床可行的方法。
在一些实施方式中,本文所提供的用于线粒体替换的方法可以用于治疗线粒体疾病或病症以及衰老、癌症和免疫系统缺陷症。
5.4.2治疗线粒体疾病或病症的方法
根据5.2节和/或5.3节中所述的任何方法,本文还提供了治疗患有或怀疑患有线粒体疾病或病症的对象的方法。在一些实施方式中,治疗患有或怀疑患有线粒体疾病或病症的对象的方法包括根据5.2节和/或5.3节中所述的任何方法产生MirC,然后向患有或怀疑患有线粒体疾病或病症的对象施用治疗有效量的线粒体替换的受体细胞。
多种线粒体疾病或病症是已知的并且全部能够使用本文所提供的方法治疗。例如,能够使用本文所提供的方法治疗的线粒体疾病或病症可以是复合物I缺乏症(OMIM:252010)。复合物I缺乏症是由其任何亚基中的突变所造成的。在另一个实施方式中,复合物I缺乏症是由选自下列的基因中的突变引起的:NDUFV1(OMIM:161015)、NDUFV2(OMIM:600532)、NDUFS1(OMIM:157655)、NDUFS2(OMIM:602985)、NDUFS3(OMIM:603846)、NDUFS4(OMIM:602694)、NDUFS6(OMIM:603848)、NDUFS7(OMIM:601825)、NDUFS8(OMIM:602141)和NDUFA2(OMIM:602137)。
另外,能够使用本文所提供的方法治疗的线粒体疾病或病症可以是复合物IV缺乏症(细胞色素c氧化酶;OMIM:220110)。复合物IV缺乏症是由其任何亚基中的突变所造成的。在某些情况下,复合物IV缺乏症是由选自下列的基因中的突变引起的:MTCO1(OMIM:516030)、MTCO2(OMIM:516040)、MTCO3(OMIM:516050)、COX10(OMIM:602125)、COX6B1(OMIM:124089)、SCO1(OMIM:603644)、FASTKD2(OMIM:612322)和SCO2(OMIM:604272)。
可以通过突变引起线粒体疾病或病症或者它与突变有关。所述突变可以是点突变、错义突变、缺失和插入。应理解mtDNA或nDNA中的突变的鉴别在本领域技术人员的技术范围内并且本文提供了示例性方法,如(例如)单核苷酸多态性(SNP)测定或者微滴式数字PCR。
能够使用本文所提供的方法治疗的线粒体疾病或病症的具体类型的非限制性实例包括鸟氨酸转氨甲酰酶缺乏症(高氨血)(OTCD)、肉毒碱O-棕榈酰基转移酶II缺乏症(CPT2)、延胡索酸酶缺乏症、与Leigh综合征有关的细胞色素c氧化酶缺乏症、槭糖尿病(MSUD)、中链酰基辅酶A脱氢酶缺乏症(MCAD)、极长链酰基辅酶A脱氢酶缺乏症(LCAD)、三功能蛋白缺乏症、进行性眼外肌麻痹伴线粒体DNA缺失(POLG)、DGUOK、TK2、丙酮酸脱羧酶缺乏症和Leigh综合征(LS)。在另一个实施方式中,线粒体疾病或病症选自阿尔珀斯病;巴斯综合症;β-氧化缺陷;肉碱-酰基-肉碱缺乏症;肉碱缺乏症;辅酶Q10缺乏;复合物II缺乏症(OMIM:252011)、复合物III缺乏症(OMIM:124000)、复合物V缺乏症(OMIM:604273)、LHON-Leber遗传性视神经病变;MM-线粒体肌病;LIMM-致死性婴儿线粒体肌病;MMC-母系肌病和心肌病;NARP-神经源性肌无力、共济失调和视网膜色素变性;Leigh病;FICP-致死性婴儿心肌病加、MELAS-相关心肌病;MELAS-线粒体脑肌病伴乳酸性酸中毒和卒中样发作;LDYT-Leber遗传性视神经病变和张力障碍;MERRF-肌阵挛性癫痫伴碎红肌纤维;MHCM-母系遗传的肥厚型心肌病;CPEO-慢性进行性眼外肌麻痹;KSS-Kearns Sayre综合征;DM-糖尿病;DMDF糖尿病+耳聋;CIPO-慢性小肠假性梗阻伴骨骼肌变性和眼肌麻痹;DEAF-母系遗传的DEAFness;PEM-进行性脑病;SNHL-感觉神经性失聪;脑肌病;线粒体细胞病;DEMCHO-痴呆病和舞蹈病;AMDF-共济失调、肌阵挛;ESOC癫痫症;视神经萎缩;FBSN家族性双侧纹状体坏死;FSGS局灶性节段性肾小球硬化症;LIMM致死性婴儿线粒体肌病;MDM骨骼肌变性和糖尿病;MEPR肌肉阵挛性癫痫和精神运动性退缩;MERME MERRF/MELAS重叠病;MHCM母系遗传的肥厚型心肌病;MICM母系遗传的心肌病;MILS母系遗传的Leigh综合征;线粒体脑心肌病;多系统线粒体病症(骨骼肌变性、脑病、失明、听力丧失、周围神经病);NAION非动脉炎性前部缺血性视神经病变;PEM进行性脑病;PME进行性肌阵挛性癫痫;RTT Rett综合征;婴儿猝亡综合征;和MIDD母系遗传性糖尿病与耳聋。
在具体的实施方式中,本文所提供的用于治疗线粒体疾病或病症的方法还可以包括由线粒体DNA异常所引起的线粒体疾病或病症,其中所述线粒体DNA异常选自慢性进行性眼外肌麻痹(CPEO)、皮尔逊综合症、科恩-塞亚综合征(Kearns-Sayre Syndrome)(KSS)、糖尿病伴耳聋(DAD)、Leber遗传性视神经病变(LHON)、LHON-加(LHON-plus)、神经病、共济失调和视网膜色素变性综合征(NARP)、母系遗传的Leigh综合征(MILS)、线粒体脑肌病、乳酸性酸中毒和中风样发作(MELAS)、肌阵挛性癫痫伴碎红纤维病(MERRF)、家族性双侧纹状体坏死/纹状体黑质变性(FBSN)、Luft病、氨基糖苷引起的耳聋(AID)和线粒体DNA综合征的多种缺失。
据认为mtDNA中的突变与多种临床病症有关。在成年人中,这些包括神经学疾病(例如,偏头痛、中风、癫痫症、痴呆病、骨骼肌变性、周围神经病、复视、共济失调、言语障碍和感觉神经性耳聋)、胃肠疾病(例如,便秘、肠易激和吞咽困难)、心脏疾病(例如,心力衰竭、心传导阻滞和心肌病)、呼吸疾病(例如,呼吸衰竭、夜间换气不足、复发吸气和肺炎)、内分泌疾病(例如,糖尿病、甲状腺疾病、甲状旁腺疾病和卵巢衰竭)、眼科疾病(例如,视神经萎缩、白内障、眼肌麻痹和上睑下垂)。在儿童中,认为与mtDNA突变有关的病症包括神经学疾病(例如,癫痫症、骨骼肌变性、精神运动性阻滞、共济失调、强直、张力障碍和感觉神经性耳聋)、胃肠疾病(例如,呕吐、发育停滞和吞咽困难)、心脏疾病(例如,双室肥厚型心肌病和节律异常),呼吸疾病(例如,中枢性通气不足和呼吸暂停)、血液学疾病(例如,贫血症和全血细胞减少症)、肾病(例如,肾小管缺陷)、肝病(例如,肝功能衰竭)、内分泌疾病(例如,糖尿病和肾上腺衰竭)和眼科疾病(例如,视神经萎缩)。因此,本文所提供的方法和组合物计划用于治疗或预防与mtDNA中的突变有关的疾病和病症。
在其它具体的实施方式中,本文所提供的方法使得能够治疗线粒体疾病或病症,其中所述线粒体疾病或病症是由核DNA异常所造成的,并且所述核DNA异常选自线粒体DNA缺失综合征-4A、线粒体隐性共济失调综合征(MIRAS)、线粒体神经胃肠道脑肌病(MNGIE)、线粒体DNA缺失综合征(MTDPS)、DNA聚合酶γ(POLG)-相关病症、感觉性共济失调性神经病伴构音障碍及眼肌麻痹(SANDO)、伴脑干与脊髓受累以及乳酸升高的脑白质病(LBSL)、辅酶Q10缺乏症、Leigh综合征、线粒体复合物异常、延胡索酸酶缺乏症、α-酮戊二醛脱氢酶复合物(KGDHC)缺乏症、琥珀酰辅酶A连接酶缺乏症、丙酮酸脱氢酶复合物缺乏症(PDHC)、丙酮酸羧化酶缺乏症(PCD)、肉毒碱棕榈酰转移酶I(CPT I)缺乏症、肉毒碱棕榈酰转移酶II(CPTII)缺乏症、肉碱-酰基-肉碱(CACT)缺乏症、常染色体显性-/常染色体隐性-进行性眼外肌麻痹(ad-/ar-PEO)、婴儿型脊髓小脑萎缩(IOSCA)、线粒体肌病(MM)、脊髓性肌萎缩(SMA)、生长停滞、氨基酸尿、胆汁郁积、铁过载、早期死亡(GRACILE)和2A型Charcot-Marei-Tooth病(CMT2A)。
具有mtDNA突变的多位个体显示出属于个别临床综合征的一组临床特征,如科恩-塞亚综合征(Kearns-Sayre Syndrome)(KSS)、慢性进行性眼外肌麻痹(CPEO)、线粒体脑肌病伴乳酸性酸中毒和卒中样发作(MELAS)、肌阵挛癫痫伴破碎样红纤维(MERRF)、神经原性无力伴共济失调和视网膜色素变性(NARP)或者Leigh综合征(LS)。然而,存在大量临床差异并且多位个体不能完全匹配到一个具体种类中,这通过疾病表型的重叠谱得到很好的说明(包括由核基因POLG的突变所产生的线粒体隐性共济失调综合征(MIRAS),其作为线粒体疾病或病症的主要原因出现)。
其中已知线粒体损伤起重要作用的示例性疾病包括(但不限于)多种神经退行性疾病的病理发生,包括阿尔茨海默氏病、帕金森氏症、亨廷顿病和肌萎缩性侧索硬化。另外,根据症状,而不是突变类型,将线粒体疾病或病症再分到一些综合征中。例如,线粒体综合征包括线粒体肌病、脑肌病、乳酸性酸中毒、卒中-样症状(MELAS)、肌肉阵挛性癫痫伴破碎样红纤维(MERRF)和Leigh综合征。
5.4.3治疗需要线粒体替换的对象的方法
根据5.2节和/或5.3节中所述的任何方法,本文还提供了治疗需要线粒体替换的对象的方法。在一些实施方式中,治疗需要线粒体替换的对象的方法包括根据5.2节和/或5.3节中所述的任何方法产生MirC,然后向需要线粒体替换的对象施用治疗有效量的线粒体替换的受体细胞。
需要线粒体替换的对象包括具有功能障碍的线粒体的任何对象。在某些实施方式中,需要线粒体替换的对象患有年龄相关疾病、线粒体疾病或病症、神经退行性疾病、视网膜疾病、糖尿病、听觉障碍、遗传疾病或它们的组合。可以受益于线粒体替换的神经退行性疾病包括(但不限于)肌萎缩性侧索硬化(ALS)、亨廷顿病、阿尔茨海默氏病、帕金森氏病、弗里德希氏共济失调、腓骨肌萎缩症和脑白质病变。视网膜疾病可以是湿性或干性年龄相关性黄斑变性、黄斑水肿或青光眼。在5.4.1和5.4.2节中更详细地描述了其它示例性疾病,如年龄相关的疾病和/或线粒体疾病或病症。
需要线粒体替换的对象还可以包括易感染线粒体功能障碍且是无症状的对象。例如,所述对象可以具有突变mtDNA,但是无(例如)线粒体疾病的表现,因此所述疾病是成年人-发病的疾病。因此,本文所提供的方法还可以通过治疗需要线粒体替换的对象用于预防本文所述的任何疾病。
5.5产生iPSC的方法
如5.2节和5.3节所述,本发明还提供了用于从非多潜能细胞产生或者提高诱导的多潜能干细胞(iPSC)的产量的方法。已证明使用干性因子,如Oct3/4、Klf4、Sox2和c-Myc的外源表达将从非多潜能细胞产生iPSC。另外,已在未分化的ESC中检测到了少量线粒体DNA(mtDNA)拷贝,同时一旦分化,该数目与线粒体成熟水平一起提高(Facucho-Oliveira JM等人,J Cell Sci 2007;120(Pt 22):4025-4034)。因此,本发明还已鉴别本文所提供的方法可以通过降低非多潜能细胞中的内源mtDNA来用于提高iPSC的产生,所述非多潜能细胞中的内源mtDNA的降低是通过将受体非多潜能细胞与减少内源mtDNA的试剂接触,将所述受体非多潜能细胞与所述试剂培育足够的一段时间以部分降低所述非多潜能细胞中的内源mtDNA,然后引入一个或多个表达盒以用于表达Oct3/4、Klf4、Sox2和c-Myc。在某些实施方式中,将外源mtDNA和/或外源线粒体无创转移至受体细胞中。
应理解用于表达Oct3/4、Klf4、Sox2和c-Myc的一个或多个表达盒的引入可以发生在减少内源mtDNA的试剂引入之前、期间或之后。因此,在一些实施方式中,用于生产iPSC的方法包括引入用于表达Oct3/4、Klf4、Sox2和c-Myc的一个或多个表达盒,将受体非多潜能细胞与减少内源mtDNA的试剂接触并且将受体非多潜能细胞与所述试剂培育足够的一段时间以部分减少所述受体细胞中的内源mtDNA。
在某些实施方式中,所述方法还包括将受体细胞与外源线粒体和/或外源mtDNA培育足够的一段时间以将所述外源线粒体和/或外源mtDNA无创转移至受体细胞。在具体的实施方式中,所述方法还包括将受体细胞与外源线粒体和/或外源mtDNA培育足够的一段时间以替换大部分内源mtDNA。包括转移外源线粒体和/或外源mtDNA和/或外源线粒体的从非多潜能细胞生产iPSC的方法还可以包括5.3节中所述的任何实施方式。
因为已在未分化的胚胎干细胞(ESCs)中检测到了少量的线粒体DNA(mtDNA)拷贝,因此本文所提供的方法还可以用于促进非多潜能干细胞中的多潜能性和减少产生iPSC所需的外源基因数。例如,在一些实施方式中,本文所提供的方法可以通过减少非多潜能细胞中的内源mtDNA用于产生iPSC,所述内源mtDNA的减少是通过将受体非多潜能细胞与减少内源mtDNA的试剂接触,将受体非多潜能细胞与所述试剂培育足够的一段时间以部分减少所述非多潜能细胞中的内源mtDNA,然后将一种或多种Oct3/4、Klf4、Sox2和c-Myc引入非多潜能细胞,借此产生多潜能干细胞。在一些实施方式中,甚至可以仅使用小分子试剂且无外源因子来产生iPSC。
在某些实施方式中,所述iPSC含有突变mtDNA。例如,所述突变mtDNA可以含有点突变,如(例如)tRNA中的点突变(例如,MELAS)。突变mtDNA还可以包括具有mtDNA的长缺失的mtDNA。在其它实施方式中,用于在产生iPSC中使用的非多潜能细胞是异质的。突变mtDNA的掺入可以有利于(例如)疾病模型的产生。
在一些实施方式中,所述非多潜能受体细胞是体细胞。在具体的实施方式中,所述非多潜能细胞是成纤维细胞。
iPSC的培养条件、鉴定和建立在本领域技术人员的技术范围内。例如,方法包括美国专利No.8,058,065和8,278,104中所提供的那些,其以其全部内容作为参考并入本文。
5.6用于测量异质性的测定
如先前所公开的,突变mtDNA和/或异质性可以导致产生功能障碍的线粒体。因此,与本文所提供的用于mtDNA替换的方法结合,用于评价线粒体功能和/或mtDNA突变的测定包括可以用于确定或预测线粒体和/或mtDNA突变的功能性的本领域技术人员已知的任何测定。
举例来说,确定线粒体功能的测定包括(例如)以下中的任一种的测量:与衰老有关的分泌因子(例如,促炎细胞因子、蛋白酶以及生长和血管生成因子,如IL-1、IL-6/VEGF、IL-8和CXCL9/MMP);通过使用Oroboros的线粒体功能;通过使用Keima-红的线粒体自噬;线粒体渗透性;线粒体膜电位;细胞色素c水平;活性氧;细胞呼吸;用于测量激活的先天免疫、超激活糖酵解的消除、ER应激的缓解、mTOR-S6途径的抑制和细胞周期激活的转录组和蛋白质组学;通过超精度显微镜所观察到和通过专门化软件定量的线粒体动态,如裂殖和融合;或者本领域中已知的测量线粒体功能的任何测定。
多种测序方法可以与本文所提供的任何方法组合使用以(1)检测突变mtDNA,(2)定量异质性,和/或(3)评价或确认外源线粒体和/或外源mtDNA的转移。大致1,100个核苷酸的段是无基因的,并且它被称为D-环、D环和控制区。D-环含有两个区,其中突变的积累比线粒体基因组中的任何其它地方更频繁。该区域分别被称为高变区HV1和HV2。因此,在一些实施方式中,可以通过mtDNA的D-环的高变区(HV)(即HV1和/或HV2)的测序,结合本文所提供的方法鉴别mtDNA突变。可以使用本领域中已知的任何测序方法进行mtDNA测序。在具体的实施方式中,所述测序方法包括单核苷酸多态性(SNP)测定。在其它实施方式中,所述测序方法包括数字PCR。在具体的实施方式中,所述数字PCR是微滴式数字PCR。
5.7组合物
本文还提供了通过5.2-5.5节中所述的任何方法获得的细胞组合物。在某些实施方式中,本文提供了组合物,其包含通过以下方法获得的一种或多种线粒体替换的细胞:(a)将受体细胞与减少内源mtDNA拷贝数的试剂接触;(b)将所述受体细胞与所述试剂培育足够的一段时间以部分减少所述受体细胞中的内源mtDNA拷贝数;和(c)将(1)其中内源mtDNA已部分减少的来自步骤(b)的受体细胞和(2)外源线粒体共培育足够的一段时间以将所述外源线粒体无创转移到所述受体细胞,借此产生线粒体替换的细胞,其中所述线粒体替换的细胞包含大于5%的外源mtDNA。在其它方面,本文提供了组合物,其包含通过以下方法获得的一种或多种线粒体替换的细胞:(a)将受体细胞与减少内源mtDNA拷贝数的试剂接触;(b)将所述受体细胞与所述试剂培育足够的一段时间以部分减少所述受体细胞中的内源mtDNA拷贝数;和(c)将(1)其中内源mtDNA已部分减少的来自步骤(b)的受体细胞和(2)来自健康供体的外源mtDNA共培育足够的一段时间以将外源mtDNA无创转移至所述受体细胞,借此产生线粒体替换的细胞,借此产生线粒体替换的细胞,其中所述线粒体替换的细胞包含大于5%的外源mtDNA。
还可以通过以下方法获得所述组合物,其包括将细胞与降低线粒体功能的试剂接触,然后将所述受体细胞与所述试剂培育足够的一段时间以部分降低所述受体细胞中的内源线粒体功能。在一些实施方式中,具有部分降低的内源线粒体功能的受体细胞然后可以与来自健康供体的外源线粒体共培育足够的一段时间以将外源线粒体无创转移至所述受体细胞,借此产生线粒体替换的细胞。在其它实施方式中,具有部分降低的内源线粒体功能的受体细胞然后可以与来自健康供体的外源mtDNA共培育足够的一段时间以将外源线粒体无创转移至所述受体细胞,借此产生线粒体替换的细胞。在一些实施方式中,通过如上所述的方法产生的线粒体替换的细胞包含大于5%的外源mtDNA。
如上所述,所述外源线粒体可以由外源mtDNA组成。因此,在一些实施方式中,将外源线粒体和外源mtDNA两者转移至所述受体细胞并且MirC具有外源线粒体和外源mtDNA两者。在其它实施方式中,通过外源线粒体将所述外源mtDNA转移至所述受体细胞,并且然后将所述外源mtDNA递送至所述内源线粒体。在特定情况下,在将外源mtDNA递送至内源线粒体之后,从细胞除去外源线粒体。因此,在一些实施方式中,MirC具有外源mtDNA,但不具有外源线粒体。
由于受体细胞的内源mtDNA部分降解,因此包含外源线粒体、外源mtDNA或它们的组合的MirC可以含有外源mtDNA和内源mtDNA两者。类似地,在其中将外源线粒体转移至受体细胞的情况下,MirC可以含有外源线粒体和内源线粒体两者。因此,在具体的实施方式中,通过本文所提供的方法获得的一种或多种线粒体替换的细胞的组合物具有内源和外源线粒体的混合物。在其它实施方式中,通过本文所提供的方法获得的一种或多种线粒体替换的细胞的组合物具有内源mtDNA和外源mtDNA的混合物(即异质mtDNA)。在其它实施方式中,相对于与减少内源mtDNA拷贝数的试剂接触前的受体细胞的总mtDNA拷贝数,所述一种或多种线粒体替换的细胞具有不大于约1.1倍,约1.2倍,约1.3倍,约1.4倍,约1.5倍或以上的总mtDNA拷贝数。
本发明还包括用于在产生线粒体替换的细胞的方法中使用的组合物,所述组合物包含减少内源mtDNA的试剂或降低线粒体功能的试剂和第二活性剂。在某些实施方式中,所述组合物还可以包括外源线粒体、一种或多种受体细胞或它们的组合。在其它实施方式中,所述组合物还可以包括外源mtDNA。
如5.3节所述,多种第二活性剂可以在用于产生一种或多种线粒体替换的细胞的方法中使用。例如,在一些实施方式中,所述第二活性剂包括大分子、小分子或细胞疗法,并且所述第二活性剂任选地选自雷帕霉素、NR(烟酰胺核糖)、苯扎贝特、艾地苯醌、重酒石酸巯基乙胺(RP103)、艾拉米肽(elamipretide)(MTP131)、奥玛韦隆(omaveloxolone)(RTA408)、KH176、凡替醌酮(Vatiquinone)(Epi743)、硫辛酸、A0001(α-生育醌)、线粒体CoQ10(MitoQ)、SkQ1(Visomitin)、白藜芦醇、姜黄素、生酮治疗、缺氧和内吞激活剂。
据发现内吞激活剂的使用提高了MTS-XbaIR质粒处理的细胞中的外源线粒体的吸收,但是对促进使用“附加(add on)”或空转染细胞的吸收无影响,这表明外源线粒体转移的这种机制对于本文所提供的发明是独特的。适合于激活胞吞的非限制性示例性化合物包括(例如)佛波醇-12-豆蔻酸酯-13-乙酸酯(PMA)(C36H56O8)、12-O-十四酰佛波醇13-乙酸酯(TPA)(C36H56O8)、丹参酮IIA磺酸钠(TSN-SS)(C19H17O6S.Na)和佛波醇-12,13-二丁酸酯或其衍生物。在一些实施方式中,所述内吞激活剂包含细胞代谢的调节剂。
可以通过任何一些熟知的技术来实现细胞代谢的调节,其包括(但不限于)本文所述的和所引用的参考文献中的那些。例如,在一些实施方式中,通过营养饥饿或营养剥夺进行细胞代谢的调节。在其它实施方式中,通过化学抑制剂或小分子进行细胞代谢的调节。在具体的实施方式中,所述化学抑制剂或所述小分子是mTOR抑制剂。
已知多种化合物抑制mTOR,包括雷帕霉素,也称为西罗莫司(CAS号53123-88-9;C51H79NO13)和雷帕霉素衍生物(例如,雷帕霉素类似物,也称为“rapalogs”)。雷帕霉素衍生物包括(例如)替西罗莫司(CAS号162635-04-3;C56H87NO16)、依维莫司(CAS号159351-69-6;C53H83NO14)和地磷莫司(CAS号572924-54-0;C53H84NO14P)。因此,在一些实施方式中,本文提供的组合物包括雷帕霉素或其衍生物。应理解如上所述用于调节细胞代谢的实施方式是非限制性的,并且调节细胞代谢不需要包括化合物或小分子并且可以包括除mTOR以外的其它途径的调节。还将理解所述组合物可以任选地包含内吞激活剂并且它不是必需组分。另外,在一些实施方式中,本文所提供的本发明可以包括非胞吞介导的mtDNA和/或线粒体转移,如在非临床背景中。
如5.5节所述,在某些实施方式中,本发明还提供了用于在从非多潜能细胞产生诱导的多潜能干细胞(iPSC)的方法中使用的组合物,其包括减少内源mtDNA的试剂,用于表达Oct3/4、Klf4、Sox2和c-Myc的一种或多种表达盒和受体细胞,其中所述受体细胞是非多潜能细胞,其中所述减少内源mtDNA的试剂以与未用减少内源mtDNA的试剂处理的非多潜能细胞相比,对于提高从非多潜能细胞产生诱导的多潜能干细胞(iPSC)的效率有效的量存在。在一些实施方式中,所述减少内源mtDNA的试剂以与未用减少内源mtDNA的试剂处理的非多潜能细胞相比,对于提高从非多潜能细胞产生诱导的多潜能干细胞(iPSC)的效率有效的量存在。这部分基于以下观察:多潜能细胞的mtDNA拷贝数减少。在具体的实施方式中,用于在生产iPSC的方法中使用的组合物还包含外源线粒体和/或外源mtDNA。
本发明还包括用于治疗年龄相关疾病、线粒体疾病或病症、神经退行性疾病、糖尿病、遗传疾病或需要线粒体替换的任何对象的药物组合物,如5.4节所述。在某些实施方式中,本文提供了包括具有来自健康供体的外源线粒体的线粒体替换的细胞的分离群体和通过本文所述的方法获得的细胞的药物组合物,如5.2-5.3节中所述。在其它实施方式中,所述药物组合物包括具有来自健康供体的外源线粒体和/或外源mtDNA的线粒体替换的细胞的分离群体和通过本文所述的方法获得的细胞,如5.2-5.3节所述。例如,在一些实施方式中,具有外源mtDNA的线粒体替换的细胞可以任选地还包括外源线粒体。在其它实施方式中,通过外源线粒体将外源mtDNA转移至细胞,递送至内源线粒体,然后从所述受体细胞除去所述外源线粒体。
本发明公开还提供了包含具有来自健康供体的外源线粒体的线粒体替换的细胞的分离群体,其中通过本文所提供的用于获得线粒体替换的细胞的任何方法获得所述细胞。在另一个方面,本发明公开提供了包含具有来自健康供体的外源mtDNA的线粒体替换的细胞的分离群体,其中通过本文所提供的用于获得线粒体替换的细胞的任何方法获得所述细胞。在一些实施方式中,包含具有来自健康供体的外源mtDNA的线粒体替换的细胞的分离群体的药物组合物还包含外源线粒体。
例如,在一些实施方式中,包含来自健康供体的外源线粒体的药物组合物是通过以下方法获得的,其包括:将细胞与减少mtDNA拷贝数的试剂接触,然后将所述受体细胞与所述试剂培育足够的一段时间以部分减少所述受体细胞中的内源mtDNA拷贝数。在一些实施方式中,具有部分减少的内源mtDNA拷贝数的受体细胞然后可以与来自健康供体的外源线粒体共培育足够的一段时间以将外源线粒体无创转移至所述受体细胞,借此产生线粒体替换的细胞。在其它实施方式中,具有部分减少的内源mtDNA拷贝数的受体细胞然后可以与来自健康供体的外源mtDNA共培育足够的一段时间以将外源线粒体无创转移至所述受体细胞,借此产生线粒体替换的细胞。在一些实施方式中,通过如上所述的方法产生的线粒体替换的细胞包含大于5%的外源mtDNA。
在其它实施方式中,通过以下方法获得所述细胞,其包括将细胞与降低线粒体功能的试剂接触,然后将所述受体细胞与所述试剂培育足够的一段时间以部分降低所述受体细胞中的内源线粒体功能。在一些实施方式中,具有部分降低的内源线粒体功能的受体细胞然后可以与来自健康供体的外源线粒体共培育足够的一段时间以将外源线粒体无创转移至所述受体细胞,借此产生线粒体替换的细胞。在其它实施方式中,具有部分降低的内源线粒体功能的受体细胞然后可以与来自健康供体的外源mtDNA共培育足够的一段时间以将外源线粒体无创转移至所述受体细胞,借此产生线粒体替换的细胞。在一些实施方式中,通过如上所述的方法产生的线粒体替换的细胞包含大于5%的外源mtDNA。所述降低线粒体功能的试剂可以短暂或永久降低线粒体功能。确定所述试剂将短暂(例如,可逆抑制剂)或永久(例如,不可逆抑制剂)降低线粒体功能的能力在本领域技术人员的技术范围内。
在本文所提供的药物组合物的某些实施方式中,通过以下方法获得所述细胞,所述方法还包括在将所述受体细胞与外源线粒体和/或外源mtDNA共培育之前,将所述受体细胞与第二活性剂接触。在一些实施方式中,所述第二活性剂选自大分子、小分子或细胞疗法,并且所述第二活性剂任选地选自雷帕霉素、NR(烟酰胺核糖)、苯扎贝特、艾地苯醌、重酒石酸巯基乙胺(RP103)、艾拉米肽(elamipretide)(MTP131)、奥玛韦隆(omaveloxolone)(RTA408)、KH176、凡替醌酮(Vatiquinone)(Epi743)、硫辛酸、A0001(α-生育醌)、线粒体CoQ10(MitoQ)、SkQ1(Visomitin)、白藜芦醇、姜黄素、生酮治疗、缺氧和内吞激活剂。在具体的实施方式中,所述内吞激活剂是细胞代谢的调节剂。在其它实施方式中,细胞代谢的调节剂包括营养饥饿、化学抑制剂或小分子。在其它实施方式中,所述化学抑制剂或所述小分子是mTOR抑制剂。在其它实施方式中,所述mTOR抑制剂包含雷帕霉素或其衍生物。
如以上5.2节中所述,多种类型的细胞可以用作受体细胞和供体细胞。例如,本发明公开描述了其中所述受体细胞是哺乳动物细胞的多种实例。然而,还将理解具有线粒体的任何细胞可以是受体细胞。因此,所述受体细胞还可以是植物细胞。
在一些实施方式中,所述动物细胞是哺乳动物细胞。在具体的实施方式中,所述细胞是体细胞。在其它实施方式中,所述体细胞是上皮细胞。在其它实施方式,所述上皮细胞是胸腺上皮细胞(TECs)。
本发明公开还提供了其中所述体细胞是免疫细胞的组合物。例如,所述组合物可以包含免疫细胞,其中所述免疫细胞是T细胞,如耗竭性T细胞。在一些实施方式中,所述组合物包括含有外源线粒体和/或外源mtDNA的复壮T细胞。例如,衰老T细胞或近衰老T细胞(例如,免疫衰老)可以用作受体细胞并且可以使用本文所提供的方法产生T细胞-来源的MirC以产生具有健康外源线粒体和/或外源mtDNA的T细胞。在具体的实施方式中,所述T细胞是CD4+T细胞。在其它实施方式中,所述T细胞是CD8+T细胞。在一些实施方式中,所述T细胞是嵌合抗原受体(CAR)T细胞。例如,在一些实施方式中,本发明公开提供了作为CAR-T细胞的MirC,它对于杀死癌细胞是有效的。MirC来源的CART可以具有延长的存活以使得能够提高免疫监视和提高癌细胞杀死。在其它实施方式中,所述免疫细胞是吞噬细胞。
如上所述,本文提供的组合物还可以包括用于在细胞中延缓衰老和/或延长寿命的组合物。所述组合物可以包括具有内源线粒体的衰老或近衰老细胞、来自非衰老的细胞的分离的外源线粒体和减少内源mtDNA拷贝数的试剂。所述组合物还可以包括具有内源线粒体的衰老或近衰老细胞、来自非衰老的细胞的分离的外源线粒体和降低线粒体功能的试剂。
本文还提供了包括来源于作为骨髓细胞的受体细胞的一种或多种线粒体替换的细胞的组合物。在具体的实施方式中,所述骨髓细胞是造血干细胞(HSC)或者间质干细胞(MSC)。例如,HSC或MSC可以分离自患有或怀疑患有线粒体疾病、年龄相关疾病或另外需要线粒体替换的对象,并且具有用外源线粒体替换的内源线粒体。随后,HSC或MSC来源的MirC然后可以移植回到需要线粒体替换的对象。在其它实施方式中,所述受体细胞是iPS细胞。所述组合物可以在临床环境中使用,并且可以在治疗年龄相关疾病,治疗线粒体疾病或病症,治疗神经退行性疾病,治疗糖尿病或遗传疾病中是有效的。例如,在一些实施方式中,使用本领域中已知的方法,所述iPSC可以在施用回所述对象之前分化成特定细胞类型。
在其它实施方式中,本文提供了包括具有减少的内源mtDNA的量的多潜能细胞的分离群体的药物组合物,其中所述细胞是通过5.5节中所述的任何实施方式获得的。在具体的实施方式中,多潜能细胞的分离群体是iPS细胞。
本文所述的细胞或化合物的施用是通过通常用于引入药物的任何途径。本发明所述的药物组合物可以包含药物可用的载体。在具体的实施方式中,术语“药物可用的”表示联邦或州政府管理机构批准的或者美国药典或其它通常承认的外国药典中所列的在动物,并且更具体地在人中使用的。术语“载体”是指治疗剂与之一起施用的稀释剂、佐剂、赋形剂或媒介物。部分通过正在施用的具体组合物以及通过用于施用所述组合物的具体方法来确定药物可用的载体。因此,存在本发明的药物组合物的多种适合的制剂(参见,例如,Remington's Pharmaceutical Sciences,第17版,1985)。
适合于施用的制剂包括水和非水溶液、等渗无菌溶液,其可以含有抗氧化剂、缓冲剂、抑菌剂和使所述制剂等渗的溶质和可以包括助悬剂、增溶剂、增稠剂、稳定剂和防腐剂的水和非水无菌混悬液。在本发明的实践中,可以(例如)口服、鼻部、局部、静脉内、腹膜内、鞘内施用组合物或将组合物施用到眼中(例如,通过滴眼剂或注射剂)。化合物的制剂可以存在于单位剂量或多剂量密封容器,如安瓿瓶和小瓶中。可以从先前所述种类的无菌粉剂、颗粒剂和片剂制备溶液和混悬液。
在本发明的背景中,施用于患者的剂量应足以在所述对象中随时间引起有益反应,即防止、改善或改进对象的病况。任何患者的最优剂量水平将取决于多种因素,其包括所使用的具体的调节剂的效力、患者的年龄、体重、身体活动和膳食情况以及取决于与其它药物的可能组合。还将通过伴随特定化合物或载体在特定对象中的施用的任何不利副作用的存在、性质和程度确定剂量大小。可以通过单一或划分剂量完成施用。
本发明的范围不被本文所述的具体实施方式限制。的确,除了所述那些之外,根据上述描述和附图,本发明的多种改变将对于本领域技术人员来说是显而易见的。这些改变旨在处于所附权利要求的范围内。
本文引用的所有专利、专利申请、公开的专利申请和其它出版物以其全部内容作为参考并入本文。如果所述术语的任何描述与作为参考并入本文的任何文档冲突,则应以本文所述的术语描述为准。
在整个本发明申请中,已参考了多个出版物。在本发明申请中,这些出版物的公开内容以其全部内容作为参考并入本文以更全面地描述本发明所属领域的技术现状。尽管已参考以上提供的实例描述了本发明,但是应理解可以在不背离本发明的精神的情况下,做出多种改变。
1.实施例
在本节中通过说明而非通过限制提供了实施例。作为本发明的示例性实施方式提供了以下实施例。不应将它们视为对本发明的宽泛范围的限制。
实施例I:MirC规程的优化显示XbaI体外降解mtDNA和MTS表达载体靶向的线粒体
图1A提供了用于产生线粒体替换的细胞(MirC)的方法的方案。首先,通过使用本领域中已知的标准技术将MTS-XbaI序列克隆到pCAGGS载体中,工程设计了用于表达熔融至线粒体-靶向序列(MTS)的XbaI限制性内切酶的哺乳动物表达载体(图1B)。在所报道的线粒体转移信号(MTS)中,我们在本研究中使用了ND4信号序列。所产生的表达载体还含有嘌罗霉素抗性基因以允许选择(图1B)。
XbaIR是最强大的核酸内切酶并且在人线粒体基因组中,在剑桥参考序列(CRS)下命名的mtDNA标准序列具有多至5个通过特定核酸内切酶靶向的识别位点(图1D)。通过体外核酸内切酶共培育验证通过XbaIR在多个位点水解分离的mtDNA(图1C)。相反,mtDNA的NotI消化显示出单一片段,如通过线粒体DNA的剑桥参考序列(CRS)所预测的(图1C)。
通过使用Nucleofector电穿孔-基转染方法,使用表达增强型绿色荧光蛋白(EGFP)的正常人皮肤成纤维细胞(NHDF)优化了质粒DNA向细胞的基因转移规程。在2μg/ml嘌罗霉素暴露1天后,建立了大于90%的效力和大于90%的存活力(图1E)。
为了具体评价MTS靶向序列的有效性,通过代替XbaIR基因亚克隆EGFP基因产生了具有与EGFP融合的MTS的质粒以产生pCAGGS-MTS-EGFP-PuroR质粒(图1F)。然后,用MTS-EGFP表达载体转染正常人皮肤成纤维细胞(NHDF)并用TMRM(四甲基罗丹明,甲酯)复染细胞,TMRM是在具有完整膜电位的活跃的线粒体中积累的细胞-渗透的染料(图1G)。
总体上,这些结果表明XbaI可以用于消化线粒体DNA,可以有效转染细胞而不影响细胞存活力,并且含有MTS的表达载体可以有效靶向线粒体。
实施例II:相对于EtBr的常规方法,核酸内切酶MTS-XbaIR处理显示出改善的mtDNA的降解
根据图2A中所示的方案,相对于使用溴化乙锭(EtBr)的常规方法,评价了MTS-XbaIR表达载体的效率和效力。在具有10%胎牛血清(FBS)和1%青霉素/链霉素(P/S)的不含丙酮酸盐的DMEM(Wako cat#044-29765)中培养了具有DsRed标记的线粒体的胎盘静脉内皮-来源的细胞系EPC100,并且在第0天,细胞是未处理的(“正常的”),用MTS-XbaIR表达载体转染的(“MTS-XbaIR”)或者用50ng/mL EtBr处理的。在第1天,在补充有100μg/mL丙酮酸盐和50μg/mL尿嘧啶核苷的具有10%FBS和1%P/S的DMEM中培养细胞。根据本领域中已知的方法,在第3和5天实施定量聚合酶链反应(qPCR)以相对于管家基因β-肌动蛋白(Actb)测量mtDNA。结果表明XbaIR将mtDNA拷贝数降低至2715.8141,然而EtBr处理仅将mtDNA拷贝数降低至5169.1258,这类似于未处理的细胞中的6189.6867的DNA拷贝数(图2B)。尽管核酸内切酶处理组中的mtDNA的减小优于用常规方法处理的组,但是它不是完全缺失并且保留了约30%的内源mtDNA(图2B)。将具有这种mtDNA部分减小的细胞称为细胞。
通过DsRed标记的线粒体的显微镜学进一步确认了相对于EtBr组,MTS-XbaIR处理组中的内源mtDNA的降解的提高(图2C)。在通过TMRM染色估计的剩余的健康线粒体体积中反映了减小水平,XbaIR处理组中的减小水平低于常规方法组(图2C)。另外,NHDF细胞的FACS分析表明在用XbaIR处理后TMRM减少(图2D)。
通过qPCR检验了质粒基因转移后XbaIR的表达动力学。在第3天,表达达到峰值,然后在第7天降至0(图2E)。所关心的其它基因(例如,GFP)验证了与XbaIR相同的动力学(图2E)。荧光图像确认与转染前相比,在嘌罗霉素选择后,在用MTS-EGFP-PuroR质粒转染的细胞中GFP富集(图2F和图2G)。通过暴露嘌罗霉素1天,GFP阳性细胞部份显著提高至几乎100%(图2F)。
这些结果证明XbaI核酸内切酶处理组中的mtDNA拷贝数的减小优于用常规EtBr方法处理的组并且未完全缺失全部内源mtDNA。此外,使用嘌罗霉素的短暂选择使得能够显著富集表达MTS构建体的细胞。
实施例III:在受体细胞中使用MTS-XbaIR构建体的内源线粒体的部分降解使得能够进行来自外源供体细胞的线粒体替换
为了评价来自健康供体细胞的外源线粒体是否可以转移至具有XbaI介导的mtDNA消除的受体细胞中,用MTS-GFP或者MTS-XbaIR质粒转染NHDF细胞并在48小时之后使用嘌罗霉素选择。在转染后6天后,将用DsRed标记的来自来源于子宫内皮的人细胞系的分离的线粒体(称为EPC100)转移到供体细胞中。图3A显示了规程方案。
在用MTS-GFP或MTS-XbaI转染并用嘌罗霉素选择后,通过TMRM染色评价线粒体含量。如图3B所示,MTS-GFP转染的细胞对TMRM显示出强染色,表明了NHDF细胞中的高线粒体水平。相反,MTS-XbaI转染的细胞(ρ-)显示出线粒体体积减小,如通过TMRM染色所显示的(图3B)。
在核中用β-肌动蛋白(Actb)调节后,通过12S-rRNA的qPCR定量线粒体DNA数,从而进一步确认了线粒体DNA的减小(图3C)。在第6天,相对于用MTS-GFP转染的NHDF对照细胞,来自MTS-XbaI转染的细胞的线粒体DNA显著减小(ρ-)(图3C)。ρ-细胞中线粒体DNA的显著减小持续了整个测定期间,其在第12天停止。具体地,在ρ-细胞中在第6天拷贝数降低至原始拷贝数的约1/3并且在第12天进一步降低至约1/4(图3C)。
通过差速离心从DsRed-Mt EMC分离线粒体。简言之,用含有蛋白酶抑制剂混合物(Sigma-Aldrich,St.Louis,Missouri,USA)的匀浆缓冲液[HB;20mM HEPES-KOH(pH 7.4)、220mM甘露糖醇和70mM蔗糖]从培养皿收获细胞。将细胞颗粒在HB中再混悬并在冰上培育5min。通过27-号针的10次轻划(stroke)在冰上使细胞破裂。将匀浆液离心(400g,4℃,5min)两次以除去未破损的细胞。通过离心(6000g,4℃,5min)收获线粒体并在HB中再混悬。使用Bio-Rad蛋白质测定试剂盒(Bio-Rad,Richmond,CA,USA)将分离的线粒体的量表示为蛋白浓度。通过将分离的线粒体与细胞在2ml标准培养基中在37℃,5%CO2共培育24h来进行线粒体转移。重要地,分离的线粒体与细胞在第12天的共培育导致mtDNA拷贝数显著升高,这与对照NHDF细胞的水平类似(图3C)。
与图2C和图2D中所示的结果一致,在MTS-XbaI转染后,细胞显示出线粒体含量降低,如通过TMRM显象所测量的。重要地,通过将细胞与分离的外源线粒体接触,可以挽救线粒体的减少,如通过DsRed标记的分离的线粒体的吸收所指示的(图3D和图3E)。相反,DsRed-标记和分离的线粒体与NHDF对照细胞或用空转染子MTS-EGFP表达载体转染的NHDF细胞的共培养显示外源线粒体聚集在细胞周围并形成聚集体,但是不能内化(图3D,下图)。尽管少部分线粒体被吞没,但是它们中的大部分保持在具有完整内源线粒体的细胞外,并且在此期间维持DsRed强度。DsRed聚集体变得更小和更少,并且DsRed强度降低,表明在外源线粒体在细胞膜上聚集后,它们被吞没并且它们的线粒体膜部分被快速消化。
现有方法之间的比较表明本发明的核酸内切酶方法在产生具有外源线粒体的线粒体替换的细胞中更有效(图3F)。例如,将本发明的核酸内切酶方法与(1)添加线粒体转移法,如我们先前的工作中所述(参见,例如,Kitani,T.等人,J Cell Mol Med(2014)18,1694)或(2)最近报道的使用通过代谢健康的细胞的分离的线粒体的旋菌接种(图3F)的方法(参见,例如,Kim,M.J.等人,Sci Rep 8,3330,(2018))。先前报道的方法(即线粒体添加;“Mt添加”或以800×g或1500×g旋菌接种)无一显示出任何显著的外源线粒体转移,如通过DsRed标记的外源线粒体的FACS分析所测量的(图3F)。另一方面,本文所提供的在外源线粒体(Mt EPC100)的无创转移后,使用MTS-XbaI介导的内源线粒体的部分降解的新方法在外源线粒体转移后显示出显著的DsRed阳性部份和提高的平均荧光强度(图3F,右上图,极右侧线)。
在线粒体生物学中所使用的先前建立的方法使用了具有完全线粒体缺失的细胞, 细胞(参见,例如,2010年9月23日提交的并且作为US 2011-0008778 A1公开的美国专利申请No.12/747,771,该专利以其全部内容作为参考并入本文)。然而,细胞不能吞没外源线粒体(图3G-图3I)。基于本文所提供的这些结果,假设细胞由于进行巨胞饮所必需的能量短缺而不能吞没外源线粒体。为了确认该假设,我们设计了基因修饰的细胞以通过暴露于引起线粒体自噬的抗霉素产生细胞,并且检验了线粒体转移水平。结果表明在具有线粒体完全缺失的细胞中未发生外源线粒体吞没(图3G-图3I)。因此,这些结果表明预先存在的mtDNA的部分缺失,而不是完全缺失是外源和胞外线粒体巨胞饮的关键因素。
另外,在用或不用外源线粒体处理的ρ(-)细胞、未转染的细胞(添加的Mt)或者用空MTS-GFP质粒处理的细胞中监测DsRed标记的外源线粒体的吸收。使用NIH图象软件每24小时定量DsRed的荧光强度。在柱状图中显示了对于初始强度的相对值(图3J)。定量表明简单添加线粒体的共培育和线粒体与空-转染子的共培育由于分离的线粒体的聚集而在相同程度提高了强度,从而表明了Ds-红标记的线粒体的积累而不是吞没。相反,与分离的外源线粒体共培育的ρ(-)细胞的强度随时间逐渐降低,表明吞没的线粒体被降解。
这些结果表明MTS-XbaI表达载体可以产生已部分缺失内源线粒体的细胞,并且可以通过转移来自供体细胞的分离的外源线粒体来挽救线粒体含量。如本文所述,本发明的方法相对于先前所述的方法,提供了改善的线粒体转移效率,如结合离心或简单“添加”线粒体而不会部分减小内源mtDNA所实施的那些。然而,不能在内源线粒体完全降解的细胞(细胞)中进行线粒体转移,这表明外源线粒体的吸收可能需要能量。
实施例IV:分离的外源线粒体与内源线粒体融合以转移供体mtDNA
为了进一步阐明完整线粒体的线粒体转移是如何发生的,单独对外膜和内膜以及拟核研究了转移到细胞中的线粒体的命运。在某些情况下,已观察到了瞬时线粒体间融合事件,其中两个线粒体紧密并置,交换可溶性膜间腔和基质蛋白并再分离,从而保持原始形态(参见,例如,Liu X等人,EMBO J.2009;28(20):3074–3089;Huang X等人.Proc NatlAcad Sci U S A.2013;110(8):2846–2851)。因此,在本文所述的条件下分析了瞬时线粒体间融合事件。
用DsRed标记来自EPC100供体细胞的分离的线粒体,并且使用具有EGFP-标记的线粒体的受体细胞。图4A显示了所使用的规程的图表。供体和固有线粒体的瞬时接触的显微镜图象显示未观察到广泛的线粒体融合(图4B和图4C)。大部分供体线粒体独立于内源线粒体存在。另外,观察到少量瞬时融合图象,并且然后供体线粒体似乎会在它最终消失前离开(图4C)。
根据图4F所示的规程进行线粒体转移。简要地,用DsRed-标记来标记受体NHDF细胞的线粒体(图4D)并且用TFAM标记来自供体EPC100细胞的线粒体,所述TFAM结合至mtDNA并且允许对线粒体示踪(图4E)。用pCAGGS-MTS-XbaIR-P2A-PuroR表达载体转染受体NHDF细胞,并在第2天用嘌罗霉素选择24小时。在第6天,实施来自EPC100供体细胞的TFAM-GFP标记的线粒体的线粒体转移。然后,在第8天,对细胞成像。线粒体转移的显微镜学显示供体拟核迁入预先存在的线粒体基质中(图4G)。外源线粒体短暂接触受体线粒体,表明通过瞬时接触将包括TFAM的线粒体拟核转移至预先存在的线粒体。
这些结果表明供体线粒体被转移至受体细胞中的线粒体基质中,并且在预先存在的线粒体减少的情况下占多数。此外,根据这些实验,几乎所有的分离的线粒体被吞没。另一方面,添加型线粒体转移和空-转染子未显示出严格的吞没,而是这些外源线粒体中的大部分聚集在细胞表面上。
总之,实施例III和IV的结果表明ρ(-)细胞降解并吞没了线粒体(图3J),并且与预先存在的线粒体短暂接触(图4B-图4C),而具有TFAM的外源mtDNA存在于预先存在的线粒体中(图4G)。
因此,假设外源线粒体能够与内源线粒体暂时相互作用,并在暂时相互作用期间转运mtDNA。然后,外源线粒体膜复合物可以在胞液中降解以提供用于重构线粒体的构建模块。接收外源线粒体的受体细胞的线粒体能够逐渐重构线粒体膜复合物并实现出功能恢复。
实施例V:在分离的外源线粒体转移后,SNP测定检测到外源线粒体增加
为了评价mtDNA替换后mtDNA的来源,使用了通过对高变区1和2测序在NHDF和EPC100之间识别的不同的核苷酸(图5A和图5B)。尽管在CRS中,NHDF在16362位保守为A,但是EPC100在相同位置具有导致从A向G改变的突变(图5B)。重要地,线粒体替换的细胞的评价表明次波中的原始核苷酸和主波中的外源核苷酸G两者的存在,这表明所述细胞是异质的(图5B,下图)。
通过单核苷酸多态性测定进一步评价了线粒体替换的NHDF中的异质性以检测受体NHDF和供体EPC100之间的差异(图5C)。使用hmt16318-F引物(5'-agccatttaccgtacatagcacatt-3'(SEQ ID NO:6))和hmt16414-R引物(5'-cacggaggatggtggtcaag-3'(SEQ ID NO:9))扩增HV1区,并且使用NHDF特异性探针(5'-CTTCTCGTCCCCATG-3'(SEQ ID NO:5))和EPC100特异性探针(5'-CCCTTCTCGCCCCCAT-3'(SEQID NO:7))(图5C)检测SNP。SNP测定结果表明在mtDNA替换后,EPC100相对于NHDF的比在第12天达到66.6%(图5D)。该结果是对先前方法的意外改善,其导致人子宫内膜腺体-来源的间充质细胞吞没相对小部分的胞外线粒体并且对异质性水平影响较小(参见,例如,Kitani,T.等人,Journal of Cellular and Molecular Medicine,18,1694-1703(2014))。
这些结果表明本文所提供的用于通过外源线粒体和/或外源mtDNA替换mtDNA的方法是完全新颖的,并且是对现有技术的改善。如本文所述,所提供的方法表明在MTS-XbaI介导的内源线粒体降解之后,线粒体的转移可以导致外源mtDNA成为主要mtDNA。
实施例VI:替换的线粒体产生能量并且MirC显示出类似于正常对照细胞的表型恢复
根据生产商的说明,通过使用Oroboros O2k研究了替换的线粒体是否工作以产生能量。使用天然对照细胞细胞和线粒体替换的细胞产生了代表性耗氧率曲线,然后计算呼吸流量和控制比(图6A和图6B)。基础呼吸、电子传递系统的最大能力和ATP产生(自由日常活动(Free Routine Activity))均显示出类似的动力学并且表明这些指数通过细胞显著降低(图6B,上方列)。重要地,通过线粒体替换的细胞,这些指数恢复至原始值(图6A和图6B)。在细胞中,非线粒体ATP产生(ROX)上调,并且耦合率下调(图6B,下方列)。细胞中的能量提供机构从线粒体ATP产生偏向糖酵解,并且这些变化在用天然细胞的mtDNA替换后逆转(图6B,右上方)。
另外,通过它们的增殖能力证实了线粒体替换的细胞(MirC)的表型恢复。具体地,细胞显示出不良的增殖能力,而MirC在第6-12天恢复至接近对照细胞的水平(图6C,右图)。
这些结果表明该方法提供了使用临床适用材料的mtDNA替换,并且导致产生了具有使得线粒体替换的细胞(MirC)能够表型恢复的功能性线粒体的细胞。
实施例VII:通过雷帕霉素的mTOR的抑制提高了细胞中外源线粒体的巨胞饮
为了确定用于提高细胞进行MirC的能力的方法,研究了调控外源线粒体的巨胞饮的机制。因为细胞由于线粒体减少而耗尽ATP,因此假设细胞的胞内高能状态类似于饥饿状态。为此,研究了两种分子途径:雷帕霉素复合物1(mTORC1)的哺乳动物靶标和AMP-激活的蛋白激酶(AMPK)。mTORC1是氨基酸、能量、氧和生长因子的必要传感器,并且是蛋白、脂质和核苷酸合成的关键调节因子。AMPK是AMP水平的传感器,并且激活导致自噬、线粒体生物发生、糖酵解和脂解。两条途径参与胞外营养物的吸收。
如图6D中所示,为了研究细胞中巨胞饮的机制,使用饥饿刺激AMPK/mTORC1,而将“药物”棕榈酸和雷帕霉素分别用于特异性刺激mTORC1激活并抑制mTORC1。将雷帕霉素以50ng/ml的浓度加入培养基24小时,并将细胞暴露于不含葡萄糖和必需氨基酸的无血清培养基1小时以模拟饥饿。尽管报道棕榈酸(PA)在200μM的浓度体内激活mTORC1,但是对于培养的成纤维细胞,PA的滴定显示基于细胞存活力,50μM的浓度和24小时的持续时间是最优的。通过使用毛细管电泳、WesTM(Protein Simple)检验了磷酸化AMPK与AMPK以及磷酸化p70S6激酶与p70 S6激酶的比,它是mTORC1的下游靶标。
使用PA或雷帕霉素处理表明尽管在细胞中未显著激活AMPK途径(图6G和图6H),但是在类似于饥饿和雷帕霉素的水平,在细胞中mTORC1途径受到显著抑制,如通过pS6/S6所测量的(图6E-图6F)。这些结果表明mTORC1代表了细胞中线粒体巨胞饮的重要靶标。
然后,在线粒体共培养期间,通过用雷帕霉素或棕榈酸同时处理细胞,我们检验了雷帕霉素和棕榈酸对线粒体吞没的影响。图6I显示了规程方案。简要地,用MTS-XbaI表达载体转染NHDF受体细胞并且在具有或不具有雷帕霉素或者具有或不具有棕榈酸(PA)的情况下培养。在48小时后对表达MTS-XbaI的细胞进行嘌罗霉素选择。在第6天,实施来自EPC100细胞的用DsRed标记的分离的线粒体的转移。在第8天,实施FACS分析以通过测量NHDF受体细胞中的DsRed表达来检测供体线粒体。
如图6I-图6L所示,雷帕霉素处理显著提高了DsRed-标记的分离的外源线粒体的吞没,而棕榈酸明显抑制它。将这些实验重复4次,并且对阳性部份进行总结,其表明在雷帕霉素和棕榈酸中对细胞存在统计学显著的差异(图6I和图6K)。值得注意地,在空转染和添加型线粒体转移两者中,无显著差异。另外,结果显示调节mTORC1活性的作用仅影响细胞的线粒体转移,而对“添加”或空转染细胞无影响,这表明这种转移外源线粒体的机制对本文所提供的发明是唯一的。
这些结果表明在线粒体转移期间,通过雷帕霉素的mTORC1的激活可以提高线粒体的巨胞饮。此外,这些方法证明对于MirC的产生,作为临床可用药物的雷帕霉素可以用于提高巨胞饮效率。
实施例VIII:在来源于Leigh综合征患者的成纤维细胞中具有异质性逆转的mtDNA替换
为了研究是否可以通过使用体外mtDNA替换技术来修正线粒体患病的细胞,将来源于诊断患有具有mtDNA T10158C突变的Leigh综合征的患者的原代成纤维细胞(7SP)用作受体细胞(图7A)。将先前在NHDF细胞中所述的相同规程应用于7SP成纤维细胞。在EPC100供体线粒体中,在第10158个核苷酸的mtDNA的DNA测序验证为T(图7B,顶部),然而7SP成纤维细胞具有主波中的T和次波中的C的马赛克,从而表明了异质性(图7B,底部)。
在线粒体替换后,7S成纤维细胞中mtDNA含量的动力学与NHDF中的几乎相同(图7C和图7J)。延时观测显示成纤维细胞显示出与细胞相同的行为。具体地,外源线粒体在细胞表面上积累的聚集体随时间变得更小或更少,并且胞液中DsRed的强度快速降低,这表明了进入胞液的有效吞没和在胞液中的消化,这与使用细胞所产生的结果一致。
重要地,线粒体替换后,在第12天,mtDNA拷贝数恢复至与原始7S成纤维细胞相同的值(图7D)。另一方面,尽管在相同条件下与分离的线粒体进行了相同的共培养,但是7SP成纤维细胞的空转染子(添加型线粒体转移)甚至不能提高mtDNA拷贝数,这表明外源线粒体转移较差(图7D,浅灰色柱)。
通过对包含10158核苷酸的线粒体基因组片段测序,检验了7S成纤维细胞中的线粒体是否含有外源和健康的mtDNA。如图7E所示,在线粒体替换后,在受体7SP细胞中,7SP细胞的mtDNA序列从在10158核苷酸位置具有大多数突变异质性(大波的C和小波的T)改变为大多数野生型mtDNA(大波的T和小波的C)(图7E,底部)。
为了产生定量信息,实施单核苷酸多态性(SNP)测定以估计使用该技术产生的异质性。使用hmt10085-F引物(5'-CAACACCCTCCTAGCCTTACTACTAA-3'(SEQ ID NO:17))和hmt10184-R引物(5'-GTCGAAGCCGCACTCGTA-3'(SEQ ID NO:20))和EPC100特异性探针(5'-ACATAGAAAAATCCACCC-3'(SEQ ID NO:18))或者7SP特异性探针(5'-CTACATAGAAAAATCCAC-3'(SEQ ID NO:19))扩增线粒体DNA的ND3区(图7F)。结果表明7SP成纤维细胞中的原始hmt10158异质性水平为约90%的突变mtDNA(图7G)。在替换后第12天,接收线粒体转移的7SP细胞中的异质性显示出少至10%的异质性水平(图7G),而空转染子(添加型线粒体转移)不会明显改变异质性并且维持了几乎相同的比或大于90%(图7H和图7I)。这些结果表明本文所提供的线粒体替换技术优于先前所报道的添加型线粒体转移。经历核酸内切酶处理的细胞将异质性改善至约75%,其中mtDNA拷贝数减少约80%。
总体上,这些结果表明可以在来自患有线粒体疾病或病症的对象的细胞中有效使用本文所述的产生线粒体替换的细胞的方法以改善异质性水平和降低突变mtDNA的量,所述方法使用MTS-XbaI来部分减少内源线粒体。
实施例IX:来源于Leigh综合征患者的成纤维细胞中的mtDNA替换获得了改善的细胞寿命和细胞代谢
评价了线粒体替换的7SP成纤维细胞的功能活性。如图8A和图8B所示,在约第12天,线粒体替换的7SP成纤维细胞的增殖能够恢复至相当于原始7SP成纤维细胞的水平。
另外,线粒体替换的7SP成纤维细胞显示出显著的寿命延长,其多至约第63次群体倍增水平(PDL),而倍增时间超过120小时,这是生长停止的阈值(图8C)。在约第8次PDL接收mtDNA替换的细胞和具有健康mtDNA的重组细胞能够持续分裂超过第55次PDL,这被认为是正常人细胞群体在细胞分裂停止之前将分裂的次数(即海弗利克极限)。相反,未治疗过的7S成纤维细胞在第25次PDL进入衰老(图8C)。因此,实验表明mtDNA替换对线粒体患病细胞的增殖和寿命具有显著影响。考虑到随衰老细胞和癌细胞而提高的衰老通常包括线粒体功能障碍,该方法可以为复壮提供重要提示,并且这可以为用于癌症疗法以及其它年龄相关疾病的疗法的新型策略提供基础。
通过测量细胞尺寸,进一步评价了线粒体转移在7S成纤维细胞中的功能性作用(图8D)。7S成纤维细胞在呼吸链中的复合物I的ND4基因的编码序列中的突变导致了对复合物I传递电子的干扰,并且伴随着其起作用以将质子从基质向上泵入膜间腔。因此,在7S成纤维细胞中,相对于线粒体ATP产生,以糖酵解为主,并且导致产生了细胞尺寸更大的补偿性改变以包含更多线粒体,尽管产生了损害和较差的功能(图8D)。相对于PDL 15(黑实线),到PDL 25,7S成纤维细胞的直径比NHDF大约1.5倍,并且到PDL 35,细胞尺寸增加加倍,并且最终尺寸增加至大约3至8倍(图8D,左图)。
与mtDNA替换后7SP细胞的功能恢复一致,在线粒体替换后,在7SP成纤维细胞中,在早期PDL中所观察到的细胞尺寸显著增加受到抑制(图8D,右图)。此外,在PDL 8接受外源线粒体的线粒体替换的7SP细胞的尺寸维持长达至第50次PDL(图8D,右图)。另外,在7SP成纤维细胞中,到第10次PDL时,柠檬酸合成酶(CS)的浓度比NHDF细胞中的CS浓度高2倍,这与7SP成纤维细胞尺寸增大的增量一致(数据未显示)。
为了确认线粒体替换后细胞功能中所观察到的改善不是由于其它细胞类型的污染,实施了可以确定区别不同来源的细胞的短串联重复序列(STR)测定(图8E)。重要地,在不同时间点,线粒体替换的细胞中的STR类型与原始7SP成纤维细胞完全相同(图8E),这表明无污染。此外,RT-PCR显示来源于表达端粒酶和E6的细胞的外源线粒体的转移不会将原代成纤维细胞转化为癌细胞(图8F)。
总体上,这些结果表明具有野生型mtDNA的外源分离的线粒体向来源于Leigh综合征患者的7SP细胞的线粒体转移提高了7SP细胞的寿命并且改善了细胞功能。重要地,所述转移不会将线粒体替换的7SP细胞转化为癌细胞。
实施例X:外源线粒体向来源于Leigh综合征患者的成纤维细胞的转移产生了功能性线粒体
通过使用Oroboros O2k,通过分析细胞的呼吸功能,进一步评价了7SP成纤维细胞中的线粒体替换的功能性作用(图9A)。结果定量表明在线粒体替换的细胞产生后,基础呼吸和ATP产生(自由日常活动)从第10次PDL持续降低至第20次PDL,并且电子传递系统的最大能力保持了7SP成纤维细胞的原始水平(图9B)。到外源线粒体转移后第30次PDL,呼吸功能的全部3个指数(常规、ETS和自由日常活动)升高,并且甚至超过了原始细胞水平(图9B)。这些结果表明在mtDNA替换后,存在用健康且非突变的复合物I重构电子传递系统的短暂延迟。质子泄露显示出与非线粒体ATP产生相同的动力学,其从早期稳定改善(图9B)。
这些结果证明外源线粒体向来源于线粒体疾病或病症患者的成纤维细胞的转移可以产生功能性线粒体。
实施例XI:外源线粒体的转移可以消散长期、持续的活性氧(ROS)产生
为了鉴定7SP成纤维细胞-来源的MirC的性质,将培养条件下的再灌注和饥饿模型两者用于7SP成纤维细胞-来源的MirC、原始7SP成纤维细胞和作为对照的NHDF。这些胁迫条件在培养细胞中引起细胞凋亡,其程度可以通过作为早期标志物的膜联蛋白V(AnnexinV)和作为晚期标志物的碘化丙啶(PI)定量。在环境危害中,再灌注损伤主要归因于线粒体功能障碍。由于mtDNA突变而易感线粒体功能障碍的细胞对再灌注损伤比健康细胞更脆弱。
将细胞以1×105个细胞每孔接种到6孔板上。第2天,将600μM H2O2(FUJIFILM WakoPure Chemical)加入细胞以用于再灌注模型或者将无血清的不含必需氨基酸(“-EAA”)的DMEM(FUJIFILM Wako Pure Chemical)用作饥饿模型的培养基。在3h H2O2或48h饥饿治疗后,用PBS清洗细胞并收集至离心管中。将膜联蛋白V-FITC和PI溶液加入细胞并使其在室温下避光反应30分钟。然后,使用488和561nm激光线对细胞快速进行FCM分析。使用SH800(Sony)收集荧光数据。通过使用FlowJo软件(TreeStar)分析流式细胞术文件。
结果表明来源于Leigh综合征对象的7SP细胞对两种胁迫形式(即H2O2和饥饿)高度敏感。如图10A-10D所示,用H2O2处理的7SP细胞在早期和晚期细胞凋亡中显示出显著增加。在再灌注模型(H2O2)中,基于膜联蛋白V(AnnexinV)和PI染色,NHDF在细胞凋亡过程中未显示出任何明显的损伤(图10B-图10D)。然而,这种轻度再灌注胁迫在7SP成纤维细胞中引起细胞凋亡。相反,膜联蛋白V(AnnexinV)和PI两者在7SP成纤维细胞-来源的MirC中的阳性部份显著低于亲代7SP成纤维细胞并且接近NHDF细胞的水平(图10B-图10D)。重要地,在7SP成纤维细胞-来源的MirC和NHDF之间无明显差异,表明MirC恢复了耐受这种轻度再灌注伤害的能力。
使用饥饿模型识别了与再灌注相同的趋势(图10E-图10H)。在7SP成纤维细胞中,在早期和晚期两者中显示出高细胞凋亡,而7SP成纤维细胞-来源的MirC显示出与NHDF几乎相同的细胞凋亡水平(基础值),其显著小于原始7SP成纤维细胞中的那些值(图10F-图10H)。这些结果进一步确认本发明的线粒体替换方法改善了受体细胞的功能恢复。
这些结果证明来自健康细胞的外源线粒体向具有突变mtDNA的细胞的转移可以改善受体细胞的功能。
实施例XII:外源线粒体向受体细胞的转移恢复了早期衰老-相关分泌表型(SASP)
本实施例证明外源线粒体向受体细胞的转移恢复了早期衰老-相关分泌表型(SASP)。由炎性细胞因子、生长因子和蛋白酶组成的SASP是衰老细胞的特征。
为了确定外源线粒体向衰老细胞的转移是否可以恢复SASP,对NHDF、7SP成纤维细胞和7SP成纤维细胞-来源的MirC细胞(其PDL几乎相同,为约15至20)在转录本水平定量测量了代表性SASP细胞因子IL-6和IL-8、趋化因子CXCL-1和生长因子ICAM1的表达水平(图11)。在7SP成纤维细胞中,IL-6显著高于NHDF和7SP成纤维细胞-来源的MirC中的那些,然而其它3种因子在这些细胞中未显示出任何显著性差异。在该PDL,7SP成纤维细胞未显示出典型的SASP,而仅是IL-6表达更高,这表明了衰老早期。重要地,在7SP成纤维细胞-来源的MirC的这种PDL中,可以恢复早期衰老过程。
总体上,这些数据证明线粒体替换不仅能够治疗具有mtDNA突变的线粒体疾病,而且还能够使衰老细胞复壮,如参与一系列疾病,包括神经退行性、心血管、代谢和自体免疫疾病并且甚至癌症的细胞。
实施例XIII:从mtDNA替换的成纤维细胞产生的iPS细胞
为了确定是否可以使用来源于具有mtDNA长缺失的患者的细胞产生诱导多潜能干细胞(iPSC),我们尝试通过适用于NHDF的具有Oct3/4、Klf4、Sox2和c-Myc(OKSM)的仙台病毒使用标准方法从7SP成纤维细胞构建iPSC。图12A中提供了规程设计图表。
在早期检测iPSC集落的碱性磷酸酶染色(AP染色)显示在第21天原始7SP成纤维细胞-来源的集落似乎具有破碎的外观,而线粒体替换的7SP成纤维细胞-来源的集落是结实的(图12B)。相反,未接受mtDNA替换的成纤维细胞不产生任何集落(图12B)。一些iPS细胞系能够从线粒体替换的7S成纤维细胞产生,如通过AP染色所测量的(图12C和图12D)。iPSC克隆在培养中是稳定的并且在单个集落之间显示出类似的形态(图12E)。免疫组织化学染色确认人多潜能干细胞标志物SOX2、OCT3/4、NANOG、SSEA4、TRA1-81和TRA1-60在过表达OKSM的线粒体替换的7SP成纤维细胞-来源的集落上的表达(图12F)。
将通过本文所述的方法所产生的iPSC与可商购的KYOU-DXR0109B人诱导多潜能干(IPS)细胞[201B7]进一步相比较。重要地,线粒体替换的7SP成纤维细胞显示出与通过健康成纤维细胞的iPS产生相同的有效水平。另外,与先前研究一致,对核β-肌动蛋白归一化的12S-rRNA的qPCR显示通过线粒体替换的7SP成纤维细胞所产生的iPS细胞相对于对照显示出一半的mtDNA含量并且mtDNA水平类似于201B7 iPSC标准品的水平(图12G)。
此外,在所产生的iPSC中hmt10158异质性水平小于10%(图12H)。绝对mtDNA拷贝数的定量确认了mtDNA水平的降低和突变mtDNA的减少(图12I)。
这些结果证明可以使用本文所提供的线粒体替换技术产生iPSC,并且其可以适用于临床领域,因为该完整程序仅使用适合于临床的材料。
实施例XIV:来自供体细胞的线粒体的线粒体替换改变了受体细胞的寿命细胞
本实施例证明mtDNA替换可以改变受体细胞的寿命。为了验证线粒体替换可以使衰老细胞复壮的假设,相对于细胞周期能力,如倍增时间和生长停止时的PDL,估计了两种模型。
使用具有早期PDL(约5至10,称为“年轻”)和晚期PDL(约40至45,称为“老”)的NHDF和TIG1胚胎肺细胞设计模型。一种模型包括用来源于老细胞的线粒体替换的年轻细胞,其表示为“O2Y”,另一种模型包括用来源于年轻细胞的线粒体替换的老细胞,其表示为“Y2O”(图13A)。
基于NHDF和TIG1之间16145位置处mtDNA的单核苷酸的差异(其分别为A和G),通过TaqMan SNP基因分型测定评价mtDNA的交换程度。NHDF-来源的MirC清楚地显示用TIG1-来源的mtDNA(hmt16145-G)替换大于90%的内源mtDNA(hmt16145-A)(图13C)。亲代TIG1细胞中所检测的小百分比的hmt16145-A被认为是背景误差(图13C)。
另外,Y2O模型清楚地显示老细胞中的寿命恢复至约65PDL(图13D)。对照老细胞和空转染子显示在55PDL时的生长停止,这与海弗利克极限一致。另一方面,O2Y显示年轻细胞的寿命缩短至约45PDL(图13E)。两种模型中约10PDL的差异可以归因于外源mtDNA。这些结果证明来自年轻细胞的外源线粒体向老细胞的转移可以使细胞复壮。
实施例XV:使用mRNA转染的来自人原代T细胞的线粒体替换的细胞(MirC)的优化
本实施例描述了使用mRNA转染的来自人原代T细胞的线粒体替换的细胞(MirC)的产生。
在实验前,经过我们的伦理委员会批准了人原代T细胞的使用。从健康志愿者抽取周围血液并使用比重为1.077的percoll以400g,20度离心35分钟以分离淋巴细胞。将1×106个细胞/ml的分离的淋巴细胞接种到涂覆了抗-CD3和抗-CD28抗体的96-孔平板上。通过将5μg/ml抗-CD3和1μg/ml抗-CD28培育过夜并在接种前2小时,在37℃预热来制备板。在接种后一天,将IL-7和IL-15分别以20μg/ml和10μg/ml的浓度加入至培养基。每3天用与初始添加相同的浓度的IL-7和IL-15更换培养基。
根据生产商的规程,使用符合GMP/GCP标准的MaxCyte电转化仪进行转染。根据生产商的规程并稍作改变,在mMESSAGE mMACHINE T7 Ultra试剂盒(Thermo Fisher)中产生mRNA。简要地,在核酸内切酶消化后,从具有DNA序列的质粒制备mRNA的DNA模板而不精制所述片段,以尽可能低地降低RNA酶混合的可能性(图14A)。
结果表明用于EGFP的mRNA产生的未精制的DNA模板导致了接近100%的基因转移效率,并且在基因转染后24小时具有高表达和高存活力(图14B和图14C)。由于高转染效率,使用这种方法不需要抗生素选择。另外,MTS-XbaIR的转染导致线粒体膜电位降低,这可以归因于内源mtDNA的减小(图14D)。
为了确定相对于分离的线粒体共培育的时机的最优规程,在8-天的一段时间内采集通过使用MaxCyte ATX的电穿孔接收GFP的mRNA的人原代T细胞的荧光图像,如所示的(图14E)。其中用GFP质粒转染细胞的对照电穿孔细胞的荧光图像(图14F,上图)显示出与成纤维细胞中的类似的动力学。表达在第2天达到峰值,并且到第8天消失。相反,与用所述质粒转移的细胞中的那些相比,接受MTS-GFP mRNA的细胞(图14F,下图)在电穿孔后4小时内显示出更高的表达,并且在第6天更早地消失。
使用毛细管电泳,通过免疫印迹分析评价了接受MTS-GFP mRNA的细胞中的GFP的蛋白表达。峰值表达发生在第4天,并且表达在第6天消失,如免疫印迹(图14H)中所示和图14G中定量的。通过qPCR进行XbaIR转录本水平的动力学定量,并且显示核酸内切酶的转录本表达在基因转移后4小时最高(图14I)。XbaIR转录本水平到第2天快速降低,并且在第6天是可忽略的(图14I)。通过定量12S rRNA(图14J)估计线粒体含量,并且表明线粒体到第2天降低至约30%,并且在整个实验期间维持在小于20%。
总体上,这些结果表明融合至MTS的核酸内切酶,如XbaI的mRNA转染可以有效降解宿主mtDNA,并且可以用于从人原代T细胞产生线粒体替换的细胞(MirC)。
实施例XVI:使用mRNA转染的来自人原代T细胞的线粒体替换的细胞(MirC)的产生
在确定在来自实施例XV的人原代T细胞中进行线粒体转移的最佳时机点后,在第7天进行线粒体共培育以防止通过任何剩余的核酸内切酶的外源mtDNA的消化。图15A显示了人原代T细胞的MirC规程方案。
为了确定线粒体替换后受体人原代T细胞中mtDNA的异质性,通过TaqMan SNP基因分型测定确定了供体线粒体和受体细胞之间的mtDNA差异。正常人原代T细胞和EPC100(线粒体供体细胞)中mtDNA的D-环的测序显示了2个核苷酸位置(核苷酸218和224mtDNA)中的差异,其对于T细胞和EPC100细胞分别为C/C和T/T(图15B)。为了描绘TaqMan SNP基因分型测定的标准曲线,将涵盖了mtDNA的218和224核苷酸的可变区片段亚克隆到pBluescriptSK(-)中。在人剑桥参考序列上定位多态性核苷酸,并且设计引物和探针来扩增和靶向D-环所期望的区域,其中所述探针具有FAM和VIC荧光团(图15C)。使用具有5'核酸外切酶活性的TaqMan聚合酶,实施qPCR并确定阈值循环数(Ct值),并将其拟合至对于每条序列使用上述质粒的几个不同的拷贝数所产生的标准曲线。在体细胞线粒体替换后,在第7天和第12天,EPC100 mtDNA来源在人T细胞中占主要地位,而接收电穿孔但无基因材料的并且以与MirC相同的规程与分离的线粒体共培育的空转染子在第7天显示出小于10%的mtDNA的外源来源并在第12天显示出背景水平(图15D)。这表明MTS-XbaIR mRNA有利于在人原代T细胞中的有效线粒体转移。
然后,为了评价线粒体转移对MirC人T细胞功能的影响,使用Oroboros O2k实施呼吸测量实验。结果表明在第7天,人T细胞-来源的MirC中的ATP产生和耦合效率恢复,然而通过使用电穿孔的XbaIR mRNA转移所产生的ρ(-)人T细胞在整个实验期间维持了ATP产生的损失(图15E)。在图15F和图15G中显示了使用耦合-控制规程(CCP)的代表性原始数据,并且显示MirC T细胞能够恢复线粒体呼吸。
这些结果证明使用GMP级电转化仪,如通过MaxCyte Inc.生产的电转化仪,人原代T细胞能够进行线粒体替换以产生MirC。
实施例XVII:使用mRNA转染的来自小鼠原代T细胞的线粒体替换的细胞(MirC)的产生
对鼠科T细胞实施了T细胞-来源的MirC的进一步鉴定。使用EasySep小鼠分离试剂盒(STEM CELL Technologies,Inc.)实施了从得自脾脏的混悬液溶液的鼠科T细胞的分离,其通过使用磁铁的阴性选择提供了高度纯化的T细胞群体。将分离的鼠科T细胞(1×106个细胞/ml)接种到具有珠-比-细胞的比值为1:1的Dynabeads小鼠T-激活因子CD3/CD28(Invitrogen,Inc.)和30U/ml的重组IL-2的96孔板上。相对于细胞生长和CD3表达确定了培养鼠科T细胞的培养基,并且发现RPMI1640优于TexMACS(图16A)。例如,与TexMACS相比,在RPMI1640中培养的细胞中存活力和细胞总数较高。每3或4天更换培养基。
然后,使用Nucleofector仪和mRNA进行鼠科T细胞的电穿孔。在mRNA转移后,GFP表达的动力学类似于人T细胞(图16B)。例如,在MTS-GFP mRNA电穿孔后6小时,发现几乎所有的细胞强烈表达GFP(图16B)。这证明高效转染了MTS-GFP。GFP强度随时间快速降低,并最终在电穿孔后第6天消失(图16B)。
MTS-XbaI mRNA的转染表明相对于人T细胞,鼠科T细胞显示出较轻的XbaIR转录本表达降低,并且甚至以低水平持续至第6天(图16C)。作为mtDNA的替代标志物的12S rRNA水平的定量表明鼠科mtDNA甚至在第6天维持在对照的约40%(图16D)。然后,在第5天进行Ds-红标记的外源线粒体和ρ(-)鼠科T细胞的共培育(图16E)。尽管相对于人T细胞XbaIR的持续时间更长并且内源mtDNA减小水平较低,但是在与分离的线粒体共培育后48小时,吞没的荧光-标记的线粒体的FACS分析显示出表达外源线粒体的T细胞的阳性部份(9.73%)(图16F)。表达外源线粒体的阳性细胞的百分比甚至高于成纤维细胞实验中的百分比,表明对于鼠科T细胞的这种规程可以是最优的以产生T细胞-来源的MirC。
实施例XVIII:外源线粒体向T细胞的转移逆转衰老
本实施例证明线粒体替换在鼠科T细胞和复壮的衰老T细胞中是成功的。
为了评价是否可以成功转移外源线粒体以产生鼠科T细胞-来源的MirC,mtDNA异质性水平是BL6(受体)细胞和NZB(供体)细胞的。对于ND1验证了2766和2767mtDNA的两个连续多态性(图17A)。具体地,BL6线粒体在mtDNA的位置2766和2767含有AT,然而NZB线粒体在相同位置含有GC。设计了引物组和两个探针,从而对于GC和AT多态性中的每一种,使用不同的荧光团来区分多态性(图17B)。另外,产生了两个不同的质粒以分别表达GC和AT多态性,并且产生了标准曲线以帮助MirC中异质性的定量测定。
用MTS-XbaI转染并且与分离自NZB小鼠的线粒体共培育的BL6细胞中的线粒体替换(XbaIR Mt)的定量证明外源mtDNA占绝大多数,然而在电穿孔后在不存在核酸内切酶的mRNA的情况下与分离的线粒体共培育的空转染子未吞没任何外源mtDNA(图17C)。该结果证明T细胞对线粒体替换是许可的。
由于本文所述的结果证明成纤维细胞-来源的MirC可以经历体外复壮(图13),因此还对T细胞-来源的MirC检查了复壮潜能。从大于80周大的小鼠(C57BL/6)的脾脏制备了来自老鼠科T细胞的受体细胞,并且从约10周大的小鼠(C57BL/6)肝脏分离了供体鼠科线粒体。已报道端粒长度随年龄缩短。因此,通过使用绝对小鼠端粒长度定量qPCR测定试剂盒(ScienCell,Inc.)测量端粒长度。在用MTS-XbaIR mRNA处理老鼠科细胞并与来自年轻供体细胞的外源线粒体共培育以产生MirC(年轻至老:YtoO)后,观察到相对于原始老T细胞,端粒长度增加1.7-倍(图17D)。这表明线粒体替换的细胞显示出复壮特征。
另外,使用先前所述的相同的代表性标志物组评价SASP(图11)。CXCL1、ICAM1、IL-6和IL-8的测量显示鼠科T细胞-来源的MirC降低了IL-6和CXCL-1,并且在ICAM-1和IL-8中未显示出变化(图17E)。这些结果表明对于MirC T细胞,SASP降低。
此外,已发现与年轻T细胞相比,衰老的T细胞显示出更高的DNA损伤应答(DDR)。因此,对于MirC和原始T细胞,使用组蛋白2A(H2A)磷酸化抗体测量DDR。结果表明与原始T细胞(4.75%)相比,DDR的阳性部份在MirC中较低(1.53%)(图17F)。因此,MirC T细胞具有较低的DDR水平,表明了衰老行为的逆转。
这些体外结果支持了体细胞线粒体替换在MirC mtDNA中被验证,以及该替换导致了指示MirC T细胞中衰老逆转的多种改变。
实施例XIX:使用含有来自年轻小鼠的外源线粒体的来源于老T细胞的MirC通过过继性细胞移植(ACT)减轻肿瘤生长
为了检验线粒体替换使衰老细胞复壮的功能潜力,实施了过继性细胞移植(ACT)实验。将注射了石棉纤维的来源于C57BL/6J小鼠腹膜腔的AE17间皮瘤细胞系用于在小鼠中发展肿瘤形成。使用该模型的先前实验已显示通过年轻的同基因T细胞的ACT,而不是通过老的同基因T细胞的ACT减轻了肿瘤生长(Jackaman等人OncoImmunology2019;8(4):1-16)。
为了确定通过将来自年轻小鼠的分离的外源线粒体转移至来自老小鼠的T细胞所产生的复壮的老T细胞是否显示出功能活性,将AE17细胞皮下注射到3组老小鼠中(组1:具有来自年轻小鼠的T细胞的ACT的老小鼠;组2:老小鼠;或者组3:具有来源于转移了来自年轻小鼠的外源线粒体的老小鼠的T细胞的MirC的ACT的老小鼠)(图18A)。评价了老T细胞-来源的MirC抑制肿瘤生长的能力。在ACT实验中使用了22至24个月大的C57BL/6小鼠。实验中使用的年轻小鼠为2至3个月大的小鼠。除体重测量外,使用每3天采集的照片的NIH图象测量肿瘤生长(图18B)。在第14天,以100μL Matrigel中混悬的2×106个细胞进行AE17接种,并且将T细胞转移当前认为是第0天。在第0天,将2×106个细胞的年轻T细胞或老T细胞-来源的MirC静脉内注入到具有-肿瘤的小鼠中。在同一天,腹膜内注射一次重组IL-2(2μg),然后在第2天和第3天再注射两次。
每组中的体重未显示出明显差异(图18C)。然而,肿瘤在组1小鼠(具有年轻T细胞的老小鼠)和组3小鼠(具有老T细胞-来源的MirC的老小鼠)中减小,而肿瘤在组2(空)小鼠中稳定生长(图18D)。相对平均质量显示出与各个小鼠类似的趋势,表明MirC的表现与年轻T细胞类似(图18E)。
为了验证输注的T细胞在动物中的存在,将来源于GFP转基因小鼠的T细胞植入同基因C57BL/6小鼠中,并且检验周围血液和脾脏以追踪供体细胞(图18F)。产生了检测GFP荧光的具有FSC相对于FL-1的二维图以阐明少见的群体。对于周围血液和脾脏两者产生了使用C57BL/6小鼠的阴性对照(左上图)和使用GFP转基因小鼠的阳性对照(左下图)(图18G)。在两个样品中识别了表达GFP荧光的T细胞的确定群体,尽管所述部份在周围血液和脾脏中分别为0.057%和0.9%(图18G)。在该规程中,在移植后第6天检测了转移的T细胞(图18H),其验证该规程可以用于评价转移细胞的能力。另外,当输注更大量的细胞时,发现外源T细胞输注后的嵌合性百分比提高(图18I)。
这些结果清楚地证明使用来自年轻小鼠的线粒体进入来自老小鼠的T细胞的离体MirC产生可以体内有效地起作用并且以与来自年轻小鼠的T细胞类似的水平降低肿瘤负荷。
实施例XX:造血干细胞能够产生MirC
迄今为止,造血干细胞的基因转移方法主要包括病毒载体的使用,因为靶标主要是需要缺陷基因的持续基因表达的遗传病症。因此,由于需要产生永久性基因表达,在当前的造血干细胞的基因转移的规程中不使用电穿孔。相反,本文所提供的线粒体替换技术的目标在于实现核酸外切酶的瞬时高表达。
基于成纤维细胞和T细胞的实验,调整了核转染(Nucleofector)/使用mRNA的电穿孔的条件,并且对鼠科胎儿肝脏-来源的Sca-1阳性细胞(其被认为是造血干细胞(HSC)的富集群体,图19A)检验了几个条件。在几个条件中,通过免疫荧光和细胞存活力评价了三种条件(机器供应商中的代码:程序X-001、Y-001和T-030)(图19A)。根据所使用的程序(分别为程序X-001、Y-001和T-030),将实验条件称为MTS-GFP1、2和3。
在用GFP的mRNA电穿孔后第1天,通过FACS分析对平均荧光强度(MFI)进行了进一步的分析(图19B)。结果表明最佳条件为X-001程序(MTS-GFP1),因为尽管在该条件中MFI右移很少,但是与其它相比,它较明显(图19B)。将鼠科骨髓-来源的Sca-1细胞与分离自同基因鼠科细胞的线粒体共培育,所述同基因鼠科细胞是表达DsRed荧光的稳定的基因-修饰的细胞系。共培育之后48小时的骨髓-来源的Sca-1细胞的3-D荧光图像显示外源线粒体被吞没(图19C)。通过FACS分析,对DsRed荧光轴估计了线粒体转移效率,并且显示约10%的Sca-1亚群显示出荧光右移,从而表明BM-来源的Sca-1阳性细胞可以经历体细胞线粒体替换(图19D)。然而,外源线粒体在无内源线粒体消除的MTS-GFP表达细胞中的转移对于临床应用过低。
然后,我们检验了通过使用MTS-XbaIR mRNA转移的ρ(-)细胞的产生的这种线粒体替换程序是否可以适用于造血干细胞(图19E)。真实的造血干细胞群体被认为是c-kit+、Sca-1+、Lineage-、CD34-(称为KSLC),它们占全骨髓细胞的约0.005%(Wilkinson,A.C.等人.Nature,571(7763):117-121(2019))。在对来自鼠科骨髓-来源的细胞的KSL细胞进行FACS分选后(图19F),在存在干细胞因子和TPO以及聚乙烯醇(PVA)的情况下,将KSL细胞培养5天。宏观地,KSL细胞维持了形态并且显示出19小时的短倍增时间(图19G)。
如上所述,使用TaqMan SNP基因分型测定评价了异质性变化。图19H中显示了测定方案。鼠科KSLC-来源的MirC证明在通过电穿孔的核酸内切酶mRNA转移后的第6天,在NZB中具有多态性的外源mtDNA为99.9%(图19I),其表示外源mtDNA几乎完全替换了CL57BL/6的内源mtDNA。这些结果证明造血干细胞允许该技术产生MirC。
实施例XXII:用于mtDNA和异质性测量的微滴式数字PCR(ddPCR)
本实施例表明可以使用数字PCR(dPCR)对线粒体DNA(mtDNA)测定特异性mtDNA序列的存在,如mtDNA中的突变。微滴式数字PCR(ddPCR)是用于实施基于水油乳液的液滴技术的数字PCR的方法。
分析了来源于线粒体疾病患者的原代皮肤成纤维细胞。下表1提供了患者信息。
表1:患者信息
将来自目标群体的细胞以每滴1个细胞的浓度与包含引物和探针的PCR混合物一起包封到液滴中。优化细胞密度以在单个液滴中产生单个细胞,并且将成纤维细胞以1×106个细胞/mL最终稀释用于ddPCR。在单细胞包封后,在液滴内进行细胞胞溶和靶标序列的扩增。具有荧光信号的液滴数表示具有靶标或参考基因的细胞数。
简要地,如下表2所述制备20×引物/探针混合物。标准ddPCR master混合物(master mix)为包含上述引物/探针混合物、模板DNA和2×ddPCR超级混合物(super mix)的25μL混合物。
表2:dPCR引物和探针混合物
20×引物/探针混合物
每100μL的体积(μL)
100μM F1引物
10
100μM R1引物
10
100μM标记探针
5
PCR级水
75
表3:dPCR反应预混合物
试剂
每25μL反应的体积(μL)
2×ddPCR超级混合物
12.5
20×引物/探针混合物
1.25
模板(100ng/μL)
1
PCR级水
10.25
使用20μL制备的qPCR样品,然后是相邻孔中的70μL液滴产生油,将样品加载到8-室筒(cartridge)内。将橡皮垫拉伸跨过所述室的顶部以确保真空密封。将每个8-室筒加载到QX100液滴产生器上,从而每个样品产生20,000个液滴。使用50μL多通道移液器,将40μL所产生的液滴转移到96-孔板并用可刺穿的箔片热密封。以50%(3℃/秒)的升温速率,使用标准2-步qPCR热循环条件,将板置于热循环仪中。在进行热循环条件之前,使用温度梯度优化引物/探针组以优化退火/延伸温度。
表4:dPCR循环条件
热循环后,将板加载到QX100液滴读板器上并分析终点反应。阳性和阴性液滴数的泊松统计分析产生了靶标序列的绝对定量。
在检验患病细胞之前,通过使用具有非突变序列(与剑桥参考序列相同)的正常人皮肤成纤维细胞(NHDF细胞)评价了对突变序列设计的探针的特异性和对非突变序列设计的探针的灵敏度(图20A-图20C)。左下区域中的点表示液滴中无细胞。3组不同的探针组的评价清楚地检测了非突变序列(BK01中的右下(图20A)、BK02中的左上(图20B)和BK04中的左上(图20C)),并且未检测到突变序列(BK01中的左上(图20A)、BK02(图20B)和BK04(图20C)中的右下)。
得自BK01的成纤维细胞的ddPCR表明了少量百分比的双重阳性群体,并且大多数是具有突变mtDNA的同型异源性的细胞(图20D)。在单细胞中不存在具有非突变mtDNA的同型异源性的明显群体。另外,BK02显示出小部分的双重阳性细胞,这表示单细胞水平中的异质性,其定义为微异质性(图20E)。BK02的结果显示了突变mtDNA的同型异源性的主要群体,并且未识别具有非突变mtDNA的同型异源性的群体。
综上,这些结果表明可以在单细胞水平准确且定量地评价同型异源性和异质性。另外,结果证明可以准确测量线粒体疾病对象的mtDNA,其可以在对象移植前用于评价治疗性组合物或者在疗法之前和/或之后用于监测mtDNA含量。
实施例XVII:受体造血干细胞或祖细胞(HSPC)中来自供体cGMP生产的骨髓来源的间充质基质细胞(BM-MSC)的mtDNA替换。
本实施例证明可以使用本文所提供的用于疗法的mtDNA替换方法来离体调节造血干细胞或祖细胞(HSPC)。
可以结合干细胞移植离体进行HSPC调节。简要地,动员外周血干细胞并且血液样品得自患者。分离外周造血干细胞或祖细胞(HSPC),例如,CD34+细胞并将其送至生产设施。在生产设施,根据本文所提供的方法部分消除线粒体。
使用得自细胞库(例如,Waisman Biomanufacturing)的现代优良制造规范(cGMP)生产的骨髓来源的间充质基质细胞(BM-MSC)分离供体线粒体。根据完全知情同意并且按照联邦条例(例如,21 CFR 1271)收集初始骨髓吸出物。在cGMP条件下处理吸出物并在早期代数入库以用于后续扩增。
将来自BM-MSC的供体线粒体转移至培养的HSPC,从而改变异质性。将修饰的HSPC送回到医疗中心用于自体同源移植(即送回到分离HSPC的相同对象)。在移植前,患者接受了可以包括非清髓性方案的最小治疗,如局部照射或亚致死剂量的抗-癌药物,如白消安。将仅含有同种异体供体线粒体的修饰的HSPC输回到患者中。
本实施例证明可以使用本文所提供的用于疗法的mtDNA替换方法来离体调节HSPC,所述疗法不包括同种异体的HSPC的移植。
如上所述的实施方式仅旨在是示例性的,并且本领域技术人员将认识到或者将能够仅使用常规实验,确定特定化合物、材料和程序的多种等价形式。所有这些等价形式被认为在本发明的范围内并且由所附权利要求所涵盖。
序列表
<110> 艾梅尔生物治疗公司(IMEL BIOTHERAPEUTICS, INC.)
<120> 用于治疗线粒体疾病或病症和异质性的方法和组合物 (METHODS ANDCOMPOSITIONS FOR TREATING MITOCHONDRIAL DISEASE OR DISORDERS ANDHETEROPLASMY)
<130> 14595-001-228
<140>
<141>
<150> 62/817,987
<151> 2019-03-13
<150> 62/731,731
<151> 2018-09-14
<150> 62/718,891
<151> 2018-08-14
<160> 47
<170> PatentIn version 3.5
<210> 1
<211> 24
<212> DNA
<213> 人工序列
<220>
<223> 人工序列的描述:合成的寡核苷酸
<400> 1
tcatccatgg ggacgagaag ggat 24
<210> 2
<211> 24
<212> DNA
<213> 人工序列
<220>
<223> 人工序列的描述:合成的寡核苷酸
<220>
<221> 修饰的碱基 (modified_base)
<222> (15)..(15)
<223> a, c, t, g, 未知或其他 (a, c, t, g, unknown or other)
<400> 2
tcatccatgg gggcnagaag ggat 24
<210> 3
<211> 24
<212> DNA
<213> 人工序列
<220>
<223> 人工序列的描述:合成的寡核苷酸
<400> 3
tcatccatgg ggacgagaag ggat 24
<210> 4
<211> 24
<212> DNA
<213> 人工序列
<220>
<223> 人工序列的描述:合成的寡核苷酸
<400> 4
tcatccatgg gggcgagaag ggat 24
<210> 5
<211> 15
<212> DNA
<213> 人工序列
<220>
<223> 人工序列的描述:合成的探针
<400> 5
cttctcgtcc ccatg 15
<210> 6
<211> 25
<212> DNA
<213> 人工序列
<220>
<223> 人工序列的描述:合成的引物
<400> 6
agccatttac cgtacatagc acatt 25
<210> 7
<211> 16
<212> DNA
<213> 人工序列
<220>
<223> 人工序列的描述:合成的探针
<400> 7
cccttctcgc ccccat 16
<210> 8
<211> 200
<212> DNA
<213> 人工序列
<220>
<223> 人工序列的描述:合成的多核苷酸
<400> 8
cagtacatag tacataaagc catttaccgt acatagcaca ttacagtcaa atcccttctc 60
gtccccatgg atgacccccc tcagataggg gtcccttgac caccatcctc cgtgaaatca 120
atatcccgca caagagtgct actctcctcg ctccgggccc ataacacttg ggggtagcta 180
aagtgaactg tatccgacat 200
<210> 9
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> 人工序列的描述:合成的引物
<400> 9
cacggaggat ggtggtcaag 20
<210> 10
<211> 53
<212> DNA
<213> 人工序列
<220>
<223> 人工序列的描述:合成的寡核苷酸
<400> 10
accacaactc aacggctaca tagaaaaatc caccccttac gagtgcggct tcg 53
<210> 11
<211> 53
<212> DNA
<213> 人工序列
<220>
<223> 人工序列的描述:合成的寡核苷酸
<400> 11
accacaactc aacggctaca tagaaaaacc caccccttac gagtgcggct tcg 53
<210> 12
<211> 24
<212> DNA
<213> 人工序列
<220>
<223> 人工序列的描述:合成的寡核苷酸
<400> 12
acatagaaaa acccacccct tacg 24
<210> 13
<211> 24
<212> DNA
<213> 人工序列
<220>
<223> 人工序列的描述:合成的寡核苷酸
<400> 13
acatagaaaa acccacccct tacg 24
<210> 14
<211> 24
<212> DNA
<213> 人工序列
<220>
<223> 人工序列的描述:合成的寡核苷酸
<400> 14
acatagaaaa atccacccct tacg 24
<210> 15
<211> 24
<212> DNA
<213> 人工序列
<220>
<223> 人工序列的描述:合成的寡核苷酸
<400> 15
acatagaaaa atccacccct tacg 24
<210> 16
<211> 200
<212> DNA
<213> 人工序列
<220>
<223> 人工序列的描述:合成的多核苷酸
<400> 16
tataaatagt accgttaact tccaattaac tagttttgac aacattcaaa aaagagtaat 60
aaacttcgcc ttaattttaa taatcaacac cctcctagcc ttactactaa taattattac 120
attttgacta ccacaactca acggctacat agaaaaatcc accccttacg agtgcggctt 180
cgaccctata tcccccgccc 200
<210> 17
<211> 26
<212> DNA
<213> 人工序列
<220>
<223> 人工序列的描述:合成的引物
<400> 17
caacaccctc ctagccttac tactaa 26
<210> 18
<211> 18
<212> DNA
<213> 人工序列
<220>
<223> 人工序列的描述:合成的探针
<400> 18
acatagaaaa atccaccc 18
<210> 19
<211> 18
<212> DNA
<213> 人工序列
<220>
<223> 人工序列的描述:合成的探针
<400> 19
ctacatagaa aaatccac 18
<210> 20
<211> 18
<212> DNA
<213> 人工序列
<220>
<223> 人工序列的描述:合成的引物
<400> 20
gtcgaagccg cactcgta 18
<210> 21
<211> 12
<212> DNA
<213> 人工序列
<220>
<223> 人工序列的描述:合成的寡核苷酸
<400> 21
tacttaacca cc 12
<210> 22
<211> 12
<212> DNA
<213> 人工序列
<220>
<223> 人工序列的描述:合成的寡核苷酸
<400> 22
tacttgacca cc 12
<210> 23
<211> 40
<212> DNA
<213> 人工序列
<220>
<223> 人工序列的描述:合成的寡核苷酸
<400> 23
caagcaagta cagcaaccaa ccctcaacta tcacacatca 40
<210> 24
<211> 40
<212> DNA
<213> 人工序列
<220>
<223> 人工序列的描述:合成的寡核苷酸
<400> 24
caagcaagta cagcaatcaa ccttcaacta tcacacatca 40
<210> 25
<211> 400
<212> DNA
<213> 人工序列
<220>
<223> 人工序列的描述:合成的多核苷酸
<400> 25
attctaattt aaactattct ctgttctttc atggggaagc agatttgggt accacccaag 60
tattgactca cccatcaaca accgctatgt atttcgtaca ttactgccag ccaccatgaa 120
tattgtacgg taccataaat acttgaccac ctgtagtaca taaaaaccca atccacatca 180
aaaccccctc cccatgctta caagcaagta cagcaatcaa ccctcaacta tcacacatca 240
actgcaactc caaagccacc cctcacccac taggatacca acaaacctac ccacccttaa 300
cagtacatag tacataaagc catttaccgt acatagcaca ttacagtcaa atcccttctc 360
gtccccatgg atgacccccc tcagataggg gtcccttgac 400
<210> 26
<211> 22
<212> DNA
<213> 人工序列
<220>
<223> 人工序列的描述:合成的寡核苷酸
<400> 26
ctctgttctt tcatggggaa gc 22
<210> 27
<211> 21
<212> DNA
<213> 人工序列
<220>
<223> 人工序列的描述:合成的寡核苷酸
<400> 27
atccatgggg acgagaaggg a 21
<210> 28
<211> 23
<212> DNA
<213> 人工序列
<220>
<223> 人工序列的描述:合成的寡核苷酸
<400> 28
ccttgttccc agaggttcaa atc 23
<210> 29
<211> 24
<212> DNA
<213> 人工序列
<220>
<223> 人工序列的描述:合成的寡核苷酸
<400> 29
tctttattaa tatcctaaca ctcc 24
<210> 30
<211> 29
<212> DNA
<213> 人工序列
<220>
<223> 人工序列的描述:合成的寡核苷酸
<400> 30
aaaggatccc cttgttccca gaggttcaa 29
<210> 31
<211> 25
<212> DNA
<213> 人工序列
<220>
<223> 人工序列的描述:合成的寡核苷酸
<400> 31
tgttctttat taatgcccta acact 25
<210> 32
<211> 200
<212> DNA
<213> 人工序列
<220>
<223> 人工序列的描述:合成的多核苷酸
<400> 32
gcgtaagact taaaaccttg ttcccagagg ttcaaatcct ctccctaata gtgttcttta 60
ttaatatcct aacactcctc gtccccattc taatcgccat agccttccta acattagtag 120
aacgcaaaat cttagggtac atacaactac gaaaaggccc taacattgtt ggtccatacg 180
gcattttaca accatttgca 200
<210> 33
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> 人工序列的描述:合成的寡核苷酸
<400> 33
tgccgtatgg accaacaatg 20
<210> 34
<211> 41
<212> DNA
<213> 人工序列
<220>
<223> 人工序列的描述:合成的寡核苷酸
<400> 34
gaatggggac gaggagtgtt aggatattaa taaagaacac t 41
<210> 35
<211> 41
<212> DNA
<213> 人工序列
<220>
<223> 人工序列的描述:合成的寡核苷酸
<400> 35
gaatggggac gaggagtgtt agggcattaa taaagaacac t 41
<210> 36
<211> 28
<212> PRT
<213> Unknown
<220>
<223> 未知的描述:COX10 MTS肽
<400> 36
Met Ala Ala Ser Pro His Thr Leu Ser Ser Arg Leu Leu Thr Gly Cys
1 5 10 15
Val Gly Gly Ser Val Trp Tyr Leu Glu Arg Arg Thr
20 25
<210> 37
<211> 24
<212> PRT
<213> Unknown
<220>
<223> 未知的描述: COX8 MTS肽
<400> 37
Met Ser Val Leu Thr Pro Leu Leu Leu Arg Ser Leu Thr Gly Ser Ala
1 5 10 15
Arg Arg Leu Met Val Pro Arg Ala
20
<210> 38
<211> 17
<212> DNA
<213> 人工序列
<220>
<223> 人工序列的描述:合成的探针
<400> 38
agcaatcaac cttcaac 17
<210> 39
<211> 15
<212> DNA
<213> 人工序列
<220>
<223> 人工序列的描述:合成的探针
<400> 39
caaccaaccc tcaac 15
<210> 40
<211> 22
<212> DNA
<213> 人工序列
<220>
<223> 人工序列的描述:合成的引物
<400> 40
ccccatgctt acaagcaagt ac 22
<210> 41
<211> 22
<212> DNA
<213> 人工序列
<220>
<223> 人工序列的描述:合成的引物
<400> 41
ttggagttgc agttgatgtg tg 22
<210> 42
<400> 42
000
<210> 43
<400> 43
000
<210> 44
<400> 44
000
<210> 45
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述:合成的肽
<400> 45
Met Asn Ser Thr Val Asn Phe Gln Leu Thr Ser Phe Asp Asn Ile Gln
1 5 10 15
Lys
<210> 46
<211> 47
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述: 合成的多肽
<400> 46
Met Asn Phe Ala Leu Ile Leu Met Ile Asn Thr Leu Leu Ala Leu Leu
1 5 10 15
Leu Met Ile Ile Thr Phe Trp Leu Pro Gln Leu Asn Gly Tyr Met Glu
20 25 30
Lys Ser Thr Pro Tyr Glu Cys Gly Phe Asp Pro Met Ser Pro Ala
35 40 45
<210> 47
<211> 50
<212> PRT
<213> 人工序列
<220>
<223> 人工序列的描述: 合成的多肽
<400> 47
Met Phe Phe Ile Asn Ile Leu Thr Leu Leu Val Pro Ile Leu Ile Ala
1 5 10 15
Met Ala Phe Leu Thr Leu Val Glu Arg Lys Ile Leu Gly Tyr Met Gln
20 25 30
Leu Arg Lys Gly Pro Asn Ile Val Gly Pro Tyr Gly Ile Leu Gln Pro
35 40 45
Phe Ala
50
